서 론
최근 우리나라 전역에서는 가뭄으로 인하여 수분공급이 충분하지 않아 가로수 일대의 고사가 빈번히 발생되고 있다. 특히 봄철은 식물의 생장이 가장 왕성한 시기로 이 시기의 가뭄은 식물의 정상적인 생육과 생산성에 큰 피해를 입힐 수 있다. 또한 기상조건에 따른 물 부족 현상은 매년 정확한 예측과 대응이 어려운 실정이며, 식물의 생육에 필요한 수분 부족은 식물의 건전한 생육을 저해시킨다(Lee and Lee, 2017).
수분은 식물이 생장에 관여하는 여러 가지 환경인자 중 가장 부족하기 쉬운 요인이며, 건조 스트레스로 인한 토양수분 감소는 수목의 생존을 위협하며 다양한 형태적, 생리적 변화를 유도한다(Hopkins, 1999). 건조 스트레스의 초기에는 팽압에 영향을 받는 요소들이 감소하여 잎의 탈리, 기공폐쇄 등 수분보존과 수분이용효율을 높이는 기작을 보이지만, 건조가 심해짐에 따라서 광합성 속도의 급격한 감소, 삼투조절기능(osmoregulation)상실 등 세포 내 주요대사에 영구적인 손상을 끼치게 된다(Hopkins and Huner, 2008; Taiz and Zeiger, 2006). 또한 식물체 내 건조 스트레스에 대응하기 위한 식물호르몬과 관련된 여러 반응이 일어나게 된다(Taiz and Zeiger, 2006). 이러한 수분 스트레스에 대응하기 위해 수종마다 다양한 생존전략을 가지고 있으며, 이러한 능력은 식물의 양적 형질로써 여러 가지 기작의 상호작용에 의하여 수종별 내건성을 나타내고 있다(Oh and Koh, 2004).
식물의 생리적 피해 및 적응 기작을 이해하기 위해서는 복합적인 고찰이 필요하며, 건조 스트레스에 따른 광합성 활성과 광계Ⅱ에서 일어나는 광화학 반응 및 전자 흐름의 불균형 등에 관한 정보는 적응 기작을 구명하는데 유용한 지표로 활용되고 있다. 특히 엽록소 형광 반응은 광합성 기구의 변화를 모니터링하여 정량화 할 수 있는 민감하고 신뢰성있는 방법으로 엽록소 형광반응 측정을 통해 광계Ⅱ의 구조와 기능변화를 빠르고 간편하게 측정할 수 있어 최근 많은 연구가 이루어지고 있다(Strasser et al., 2000; Naumann et al., 2007; Falqueto et al., 2010; Wang et al., 2012). 이렇듯 건조 스트레스에 따른 근본적인 메커니즘을 구명하는 것은 수목의 생장과 산림 생산성에 매우 중요하다(Gessler et al., 2017).
식물의 건조 스트레스에 따른 생리적 반응과 관련하여 국외에서는 사막과 같은 건조한 지역에서 생육하는 식물에 관한 연구가 많이 이루어져 왔다(Bargali and Tewari, 2004; Bowman and Roberts, 1985). 우리나라에서도 주요 수목에 관해 비교적 많이 이루어져 왔으나(Kim et al., 1994; Bark et al., 2021), 벚나무류에 관한 연구로는 벚나무의 유전구조를 파악하는 계통학적 연구(Kim et al., 2005; Kim and Han, 2015), 친환경 방제 연구(Son et al., 2015; Seo et al., 2009), 추출물을 통한 항염증 효과(Kim et al., 2010) 등 계층적 분류 및 생리활성에 관한 연구가 주로 이루어지고 있으며, 다양한 환경요인에 따른 생리적 반응 등 적지생육 조건에 대한 연구는 미흡한 실정이다.
따라서 본 연구는 가로수에서 식재율이 높은 벚나무류 중 산개벚나무, 잔털벚나무를 대상으로 적정 수분환경 및 인위적인 건조 스트레스에 따른 광합성 반응과 수분부족에 대응하기 위한 방어기작을 분석하여 건전한 생육을 위한 기초자료를 확보하고자 하였다.
재료 및 방법
실험에 사용된 재료는 경남 진주시에서 재배된 4년생 접목묘 산개벚나무(Prunus maximowiczii, P. maximowiczii)와 잔털벚나무(Prunus serrulate Lindl. var. pubescens (Makino) Nakai, P. serrulate)이며, 2020년 3월 초 마사토와 원예용 혼합상토(바로커, 서울바이오)를 1:1 혼합하여 높이 35 cm, 폭 40 cm 포트에 이식하였다. 이식 후 산림바이오소재연구소 내 온실에서 1년 4개월 간 생육시킨 것 중 생육이 가장 양호한 수종별 5개체를 선발하여 실험에 사용하였다.
건조 스트레스는 비닐온실에서 2021년 8월 1일부터 8월 30일까지 30일간 인위적인 단수처리를 통하여 건조 스트레스(Drought stress, DS)를 유발하였으며, 단수처리 후 1일(DS 1), 5일(DS 5), 10일(DS 10), 15일(DS 15), 20일(DS 20), 25일(DS 25) 그리고 30일(DS 30)에 광합성 특성 및 엽록소 형광반응, 엽온을 측정하였다. 실험 기간 중 온실 내 온도, 습도 등 주요 환경인자의 변화를 조사하기 위해 온·습도 측정기(HOBO H80-004-02, ONSET, USA)를 통하여 20분마다 측정하였으며, 지상으로부터 1.5 m 높이에 설치하였다. 광질은 분광광도계(SpectraPen LM520, Photon Systems Instrumrnts Co., Drasov, Czech)를 이용하여 매일 13:00-14:00에 측정하였으며, 토양수분함량은 스마트 토양 수분센서(S-SMD-M005, ONSET, USA)를 이용하여 20분마다 5반복으로 측정하였다.
광합성은 오전 9시에서 12시 사이에 광합성 측정기(LI- 6400XT, Li-COR, lincoln, NE, USA)를 통해 생장점 아래 3번째 잎을 5개 선택하여 5 반복(총 25반복=5개체×5반복)으로 측정하였으며, 순광합성 속도(net photosynthetic rate; Pn), 기공증산속도(stomatal transpiration rate; E), 기공전도도(stomatal conductance; gH2O)를 조사하였다. 이때 공통된 측정 조건은 챔버로의 유입 공기유량을 250μmol · s−1, CO2 농도 400μmol · mol−1, 습도 60-70%, 온도 25±3°C, 광량 800 μmol · m−2 · s−1을 유지하며 측정하였다. 또한 LED light sources를 이용하여 Photosynthetic photon flux density(PPFD)를 0, 50, 100, 250, 500, 1000, 1500, 2000 μmol · m−2 · s−1의 단계를 조절하였다. 측정된 자료는 Kume and Ino(1993)식에 의해 광보상점, 광포화점, 암호흡, 순양자수율, 기공증산속도를 구했으며, 수분이용효율(Water Use Efficiency: WUE=μmolCO2/mmol H2O=net photosynthesis rate(Pn)/transpiration rate(E))을 산출하였다.
JIP 분석(polyphasic rise of Chlorophyll a fluorescence transients)은 엽록소 형광반응 측정기(FP110/D, Photon System Instruments, Czech Republic)를 이용하여 광합성 측정과 동일한 잎에 20분간 암적응 시켜 1,500 μmol · m−2 · s−1의 광량을 1초간 조사하고, 50 μs(O 단계), 2 ms(J 단계), 30 ms (I 단계), 300 ms(P 단계)에서 엽록소 형광밀도를 5반복으로 측정하였다. JIP 분석 결과를 통해 생물리학적 변수(biophysical parameters; ΦPO,ΨO, ΦEO, ABS/CS, Tro/CS, ETo/CS, DIo/CS, PIABS)를 산출(Table 1)하여 제시하였다(Strasser et al., 2000).
엽온조사는 적외선 열영상 분석기(E40, FLIR System Inc., Wilsonville, OR, USA)를 이용하여 광합성 및 엽록소 형광 측정 잎과 동일한 잎을 대상으로 촬영하였으며, 촬영된 적외선 열영상 사진은 열영상 분석 소프트웨어(Flir IR, FLAR Co., USA)를 이용하여 온도값으로 변환하였다.
결과 및 고찰
실험을 진행한 8월 1일부터 8월 31일까지 미기상 환경 및 토양 수분함량 변화는 Figure 1과 같다. 평균 기온은 26.3°C, 최고기온은 41.4°C, 최저기온은 20.8°C이였고, 8월 28일은 34.1°C, 8월 31일은 33.6°C로 낮 동안의 평균기온 28.5°C 보다 높은 고온으로 나타났으며, 실험기간 중 일교차는 평균 18.7°C로 비교적 큰 편이었다. 평균 상대습도는 87.5%, 오전 9시부터 오후 2시까지의 평균 일사량은 756.8 W · m−2로 나타났다. 특히 DS 7~10일 구간과 DS 16~18일 구간의 평균 온도는 각각 26.9, 27.2°C로 다른 시기에 비해 비교적 높은 것으로 나타났으며, 이때의 토양 수분함량 감소 역시 높은 것으로 나타났다.

토양 수분함량은 건조 스트레스 처리 전 두 수종 모두 20.1~21.2% 수준이였고, 수분 공급이 차단 된 후 DS 1일차에 산개벚나무는 19.6%, 잔털벚나무는 19.2%, DS 2~9일차까지는 각각 19.4~16.6%, 19.2~16.1%의 범위였고, DS 10~12일 사이에 두 수종 모두 10% 이하의 토양 수분함량을 보였다. 실험이 완료된 DS 30일에는 토양 수분함량이 산개벚나무는 0.2%, 잔털벚나무는 0.1%로 처리 후 1일에 비해 약 98.9~99.1% 감소한 것으로 나타났다.
토양수분의 감소는 식물과 토양의 증발산으로 인한 감소이며(Miller, 2003), 무관수 처리 후 용적수분함량의 감소는 실험조건, 방법에 따라 달라지며, 이는 식물 종, 생장단계, 토심, 일사량, 포트크기, 토양성분 등에 의해서 발생한다(Bousselt et al., 2011; VanWoert et al., 2005).
본 연구에서는 토양 수분함량이 11.4~13.6%인 DS 10일 이후부터 팽압의 감소로 인해 엽이 조금씩 말려들어가는 현상을 관찰할 수 있었고, 토양 수분함량이 1.7~2.9%인 DS 23일에서 엽의 기저부위와 말단부위에서 부분적인 위조현상이 일어나는 등 가시적인 건조 스트레스 피해가 나타나는 것을 확인할 수 있었다. 또한 토양 수분함량은 식물의 생존기간을 결정하는 중요한 요인이며(Von Willert et al., 1990), 엽과 토양 수분함량의 저하는 식물의 생장을 저해하고 기공을 닫게하여 광합성 속도를 저하시키는데(Park, 2013), 이는 식물의 생리작용 및 특성에 따라 민감도는 달라지게 된다(Hsiao, 1973).
건조 스트레스에 따른 광합성 반응의 변화는 Figure 2와 같다. 건조 스트레스가 지속됨에 따라 산개벚나무와 잔털벚나무 엽의 최대광합성속도(Pn max)는 DS 10일 이후부터 유의적인 감소를 보였으며, 최대광합성 속도의 경우 산개벚나무는 DS 15일에 4.4 μmol · CO2 · m−2 · s−1, 잔털벚나무는 DS 15일에 4.6 μmol · CO2 · m−2 · s−1로 DS 1일에 비해 56.0, 58.6% 수준으로 각각 감소하였다. 특히 토양수분함량이 8.9%에서 4.2%까지 큰 폭의 감소를 보이는 DS 15~20일 이후에 최대광합성속도 역시 급격한 감소를 보였는데, 이는 Lee et al.(2018)이 보고한 황칠나무의 경우에 토양수분함량의 감소에 따라 초기에는 광합성량이 점진적으로 감소하다가 토양수분함량이 매우 작은 환경에서 큰 폭으로 감소한다는 연구결과와 유사하게 나타났다. DS 30일에 측정된 최대광합성속도의 경우 산개벚나무는 5.2 μmol · CO2 · m−2 · s−1, 잔털벚나무는 5.4 μmol · CO2 · m−2 · s−1 로 DS 1일에 비해 각각 48.1%, 50.9% 감소하였다.
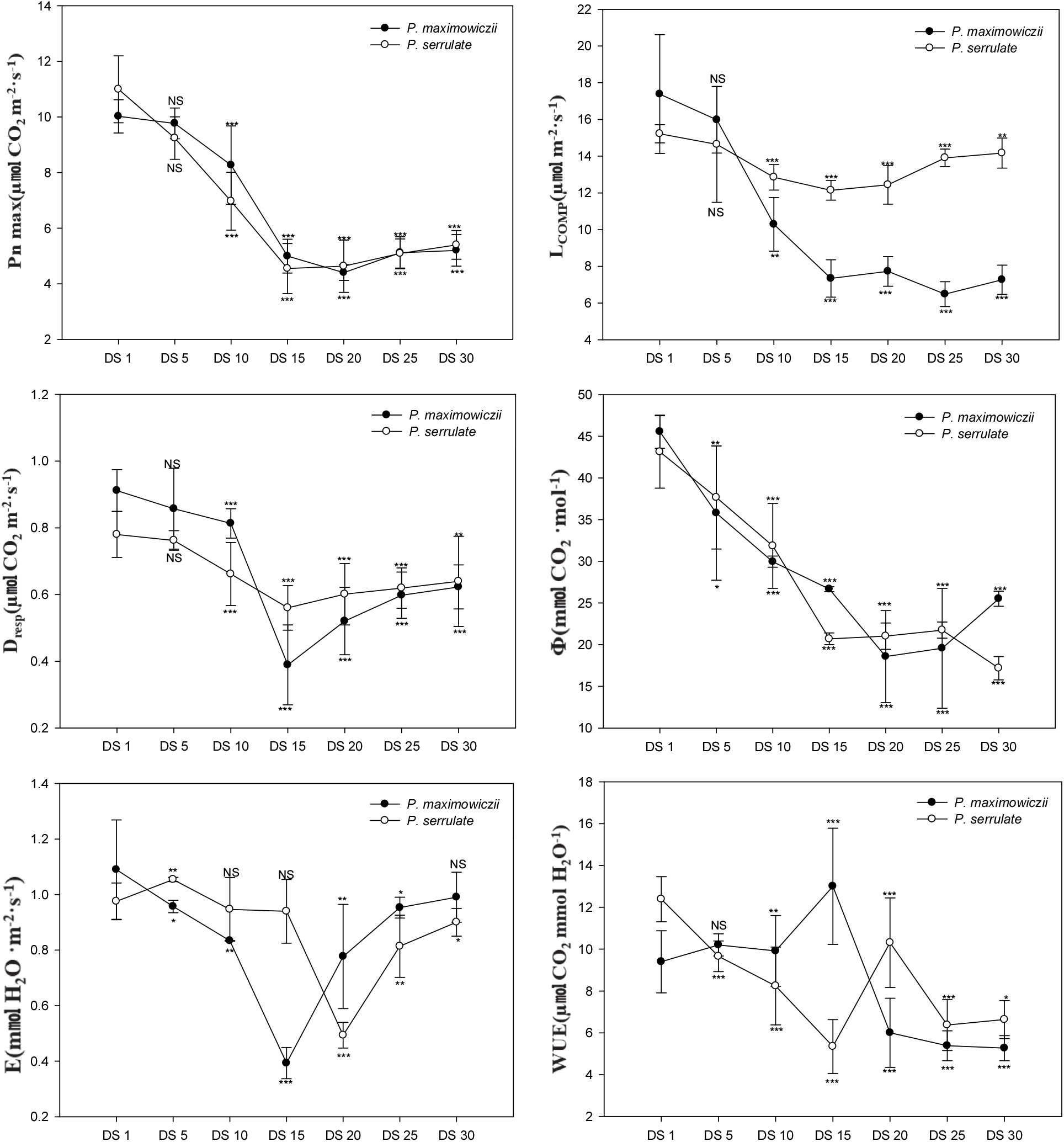
광보상점의 변화는 일정한 경향을 나타내지 않았으며 DS 1일에 비해 DS 15일 후 산개벚나무는 57.8%, 잔털벚나무는 20.2% 감소한 것으로 나타났다. DS 20일 이후부터 증가하여 DS 30일의 경우 산개벚나무는 58.2%, 잔털벚나무는 6.9%의 감소를 보였다. 암호흡의 경우 DS 15일에 산개벚나무는 0.39 μmol · CO2 · m−2 · s−1, 잔털벚나무는 0.56 μmol · CO2 · m−2 · s−1로 DS 1 일에 비해 57.3%, 28.2% 수준으로 각각 감소를 보였으며, 이 시기와 유사하게 최대광합성속도 또한 감소한 것을 알 수 있다.
순양자수율의 경우 산개벚나무는 DS 15일에 21.6 mmol CO2 · mol−1, 잔털벚나무는 DS 20일에 21.0 mmol CO2 · mol−1로 DS 1일에 비해 52.6%, 51.3% 수준으로 각각 감소하여 광화학계의 활성이 크게 저하된 것을 알 수 있었다.
대기로의 수분확산 속도크기를 의미하는 기공전도도(stomatal conductance; gH2O)는 여러 가지 환경인자들의 영향을 받으며, 기공전도도의 감소에 따라 기공증산속도(stomatal transpiration rate; E) 또한 감소되고 광합성 능력에 영향을 미치게 된다. 특히 고등식물의 광합성은 유효수분에 의해 크게 제한받게 되며, 수분공급이 제한되면 식물은 스트레스를 받게되어 체내에 ABA(abscisic acid)함량이 증가하게 된다. 이후 체내에 ABA 함량 변화에 따라 기공이 닫히기 시작하고, CO2 흡수에 영향을 미치게 되어 광합성에 부정적인 영향을 미치게 된다(Salisbury and Ross, 1992; Yu and Bae, 2004). 산개벚나무의 경우 DS 15일에 0.39 mmol H2O m−2 · s−1로 유의적으로 감소하여 DS 1일에서 나타난 1.09 mmol H2O m−2 · s−1 보다 63.9% 감소하였으며, DS 20일 이후부터 증가하는 경향을 보였다. 잔털벚나무의 경우 DS 15일까지 기공증산속도의 변화가 없었으며, DS 20일에 0.49 mmol H2O m−2 · s−1로 유의적으로 감소하여 DS 1일에서 나타난 0.98 mmol H2O m−2 · s−1 보다 49.4% 수준으로 감소하는 경향을 보였으며, DS 20일 이후 증가하는 경향을 보였다.
식물이 건조 스트레스를 받게 되면, 내부의 수분손실을 막기 위해 기공을 닫아 증산율을 낮추면서 광합성 동화산물에 대한 수분손실률인 수분이용효율을 증대시킨다(Je et al., 2006). 산개벚나무의 경우 DS 10일까지 큰 변화를 보이지 않았으나, DS 15일에 13.1 μmol CO2 mmol H2O−1로 DS 1일(9.4 μmol CO2 mmol H2O−1)에 비해 38.4% 증가하였으며, DS 20일에는 6.0 μmol CO2 mmol H2O−1로 DS 15일에 비해 53.9% 감소하였다. 잔털벚나무의 경우 DS 20일에 2.1 μmol CO2 mmol H2O−1로 DS 1일(1.1 μmol CO2 mmol H2O−1)에 비해 49.7% 증가하였으며, DS 25일에는 1.2 μmol CO2 mmol H2O−1로 DS 20일에 비해 43.2% 수준의 감소로 나타났다. 이는 건조 스트레스가 유발되면서 수분손실을 막기 위해 기공을 닫게 되어 수분이용효율이 일시적으로 증가하였으나, 스트레스가 극심한 상태에서 기공닫힘으로 인한 엽육내 CO2 함량 감소(Je et al., 2006)와 엽육세포의 탈수 및 대사장애(Taiz and Zeiger, 2006)가 동반되어 현저한 광합성 속도의 감소로 나타났으며, 그 감소율이 증산속도 감소에 비해 더 크기 때문으로 판단된다.
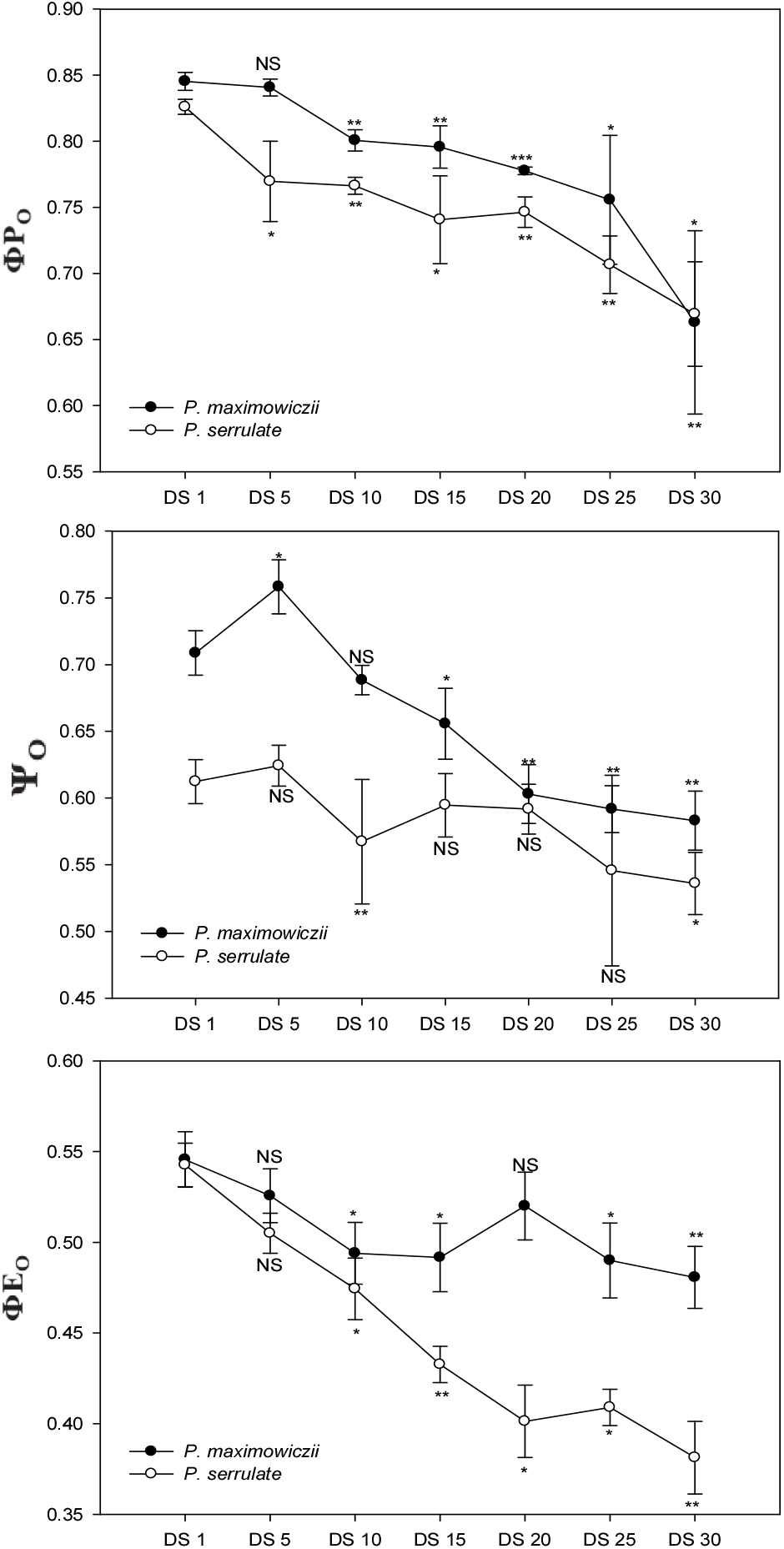
엽록소 형광은 식물의 광합성 반응 메카니즘 중 광계Ⅱ에서 엽록소에 흡수된 빛 에너지의 전자전달과 관련된 반응으로, 광화학반응에 쓰이지 못한 빛 에너지의 일부가 다시 빛으로 방출되는 현상이다(Hopkins and Hüner, 2008). 광계Ⅱ의 안테나 엽록소에 의해 흡수된 빛에너지(ABS)는 에너지 전이과정(energy transfer)을 통해 반응중심(P680)을 들뜬 상태로 만들며, 들뜬 반응 중심은 전하 분리과정으로 인접한 페오피틴(pheophytin)에 전자를 방출하고, 전하 안정화 과정을 통해 초기 전자수용체인 QA를 환원시킨다(TRo). 이 과정에서 일부 에너지는 반응중심에 포획되지 못하고 열등의 형태로 방출되며(DIo), QA의 환원 이후 일련의 전자전달계를 거쳐(ETo) 최종적으로 NADP+를 NADRH로 환원시킨다(Strasser et al., 2000). JIP 테스트는 이러한 에너지 전달과정의 특성을 잘 보여준다. 가장 초기에 나타나는 O-J구간은 광계 Ⅱ의 반응중심에 QA의 환원과 재산화 간의 불균형을 반영하며, I-P 구간은 plastoquinone pool(PQ pool)의 급격한 환원을 의미한다(Stirbet et al., 1998; Oh et al., 2009). Figure 3에 나타낸 ΦPO, ΨO, 그리고 ΦEO는 광화학반응의 각 단계에 대한 에너지전이 비율 및 형광수율을 의미하는 것으로(Strasser et al., 2000), 초기광화학반응에서 최대양자수율을 의미하는 ΦPO의 경우 두 수종 모두 DS 10일부터 다소 감소된 경향을 보였다. QA- 이후 전자전달효율인 ΨO, ΦEO에서 산개벚나무는 DS 5일에 가장 높은 경향을 보이다가 이후 감소했으며, 잔털벚나무의 경우 ΦEO에서 DS 15일부터 점진적으로 감소해 가는 경향을 나타냈다.
반응중심당 에너지 흐름의 변화를 나타내는 ABS/RC, TRO/RC, DIO/RC의 경우 산개벚나무는 DS 15일, 잔털벚나무는 DS 20일에서 증가되었으며, ETO/RC는 건조처리 기간이 길어질수록 감소된 경향을 나타냈다(Figure 4). ABS/RC의 증가는 환원상태로 존재하는 반응중심이 많아져 반응중심이 부분적으로 비활성상태임을 나타내고(Spoustovà et al., 2013), TRO/RC, DIO/RC의 증가를 통해 전반적인 활성상태의 반응중심이 감소됨에 따라 반응중심당 포획되는 에너지와 열 등으로 방출되는 에너지 모두 증가하는 것을 알 수 있다. 특히 DIO/RC의 증가는 광저해현상의 발생과 관련이 있으며, 건조스트레스에서 과다한 여기에너지의 유입으로 인한 피해를 줄이기 위한 것으로 해석할 수 있다(Falqueto et al., 2010). 또한 ETO/RC의 감소를 통해 QA의 환원 이후 광계Ⅰ의 반응중심(P700)을 환원시키기 위한 전자전달이 저해되고 있음을 알 수 있다(Lee et al., 2014).
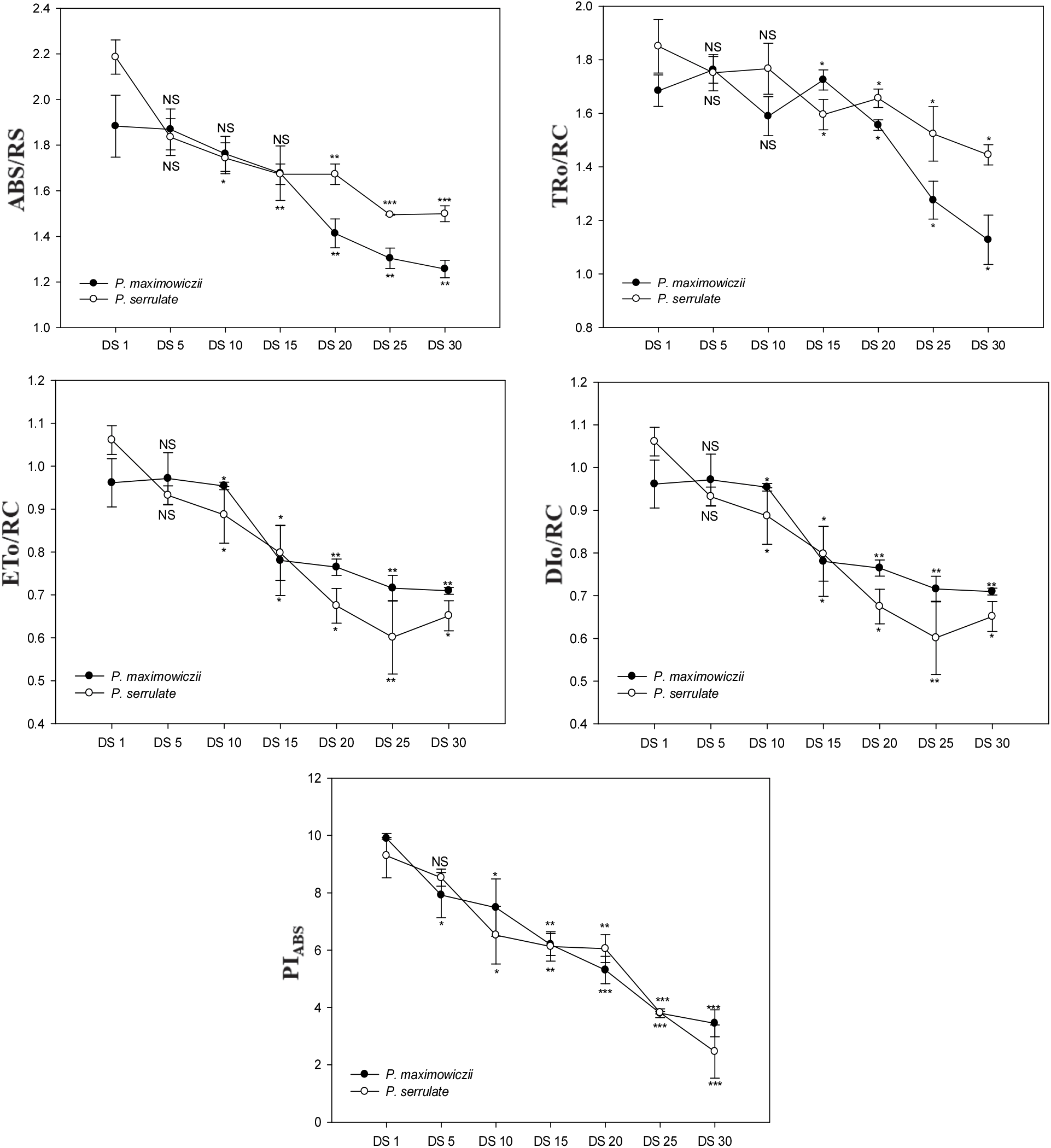
PIABS는 흡수된 빛에너지를 이용해 전자 운반자들(electroncarriers)이 환원되는 과정에서 에너지 보존효율을 의미하며(Holland et al., 2013), 광계Ⅱ의 반응중심에서 광합성 활성을 조절하는 3가지 주요한 단계, 즉 활성 반응 중심의 전체밀도, 반응중심에 의해 흡수된 에너지가 광화학과정으로 포획되는 비율, QA의 환원 후 전자수송과정 내에 전자 이동 등을 모두 반영한다. 또한 광계Ⅱ의 최대양자수율(ΦPO=FV/FM)보다 더욱 민감한 환경스트레스 지표로 알려져 있다(Strasser et al., 2000; Boureima et al., 2012; Wang et al., 2012; Zushi et al., 2012). 특히, PIABS는 건조스트레스를 평가 및 모니터링 하는데 좋은 지표로 사용되며(Van Heerden et al., 2007), 건조스트레스에 따라 PIABS는 감소되는 것으로 알려져 있다(Rathod et al., 2011; Wang et al., 2012). 산개벚나무의 경우 DS 15일부터 유의적으로 감소하여 DS 1일에 비해 59.7%으로 감소하였으며, 잔털벚나무는 DS 20일부터 유의적으로 감소경향을 보였으며, DS 1일에 비해 53.6% 수준으로 감소경향을 보였다.
전반적으로 산개벚나무는 DS 15일, 잔털벚나무는 DS 20일 이후 광화학과정에 이용하기 위해 포획되는 에너지가 줄어들고 전자전달에 이용되지 못하는 에너지는 증가하여 광계Ⅱ의 활성이 감소하는 것으로 나타났으며, 극심한 건조스트레스 시 과도한 여기에너지로 인한 광산화를 막기 위해 환원상태의 반응중심과 비광화학적 에너지의 소실을 증가시키는 기작을 보였다. 또한 ΦPO, ABS/RC, PIABS는 광합성 속도의 감소 및 가시적인 징후가 나타나기 전에 유의적인 감소 반응을 보여 건조스트레스에 따른 생리적 기작의 진단 지표로 이용될 수 있을 것으로 판단된다.
엽온은 식물의 현재 생육상태를 판단하는 주요 지표로 태양 복사 등의 유입에너지와 식물의 증산에 따른 잠열 형태의 에너지 유출 등 열수지에 의해 결정된다(Park et al., 2017; Seo et al., 2018). Jackson et al.(1981)은 식물이 정상적으로 증산하고 있을 때 식물 엽온(Ts)은 기온(Ta)보다 낮으며, 증산이 원활하지 않을 경우 반대 현상을 보인다.
건조처리 기간에 따른 Ts-Ta의 변화를 조사한 결과는 Figure 5와 같다. 하루 중 태양고도가 가장 높아서 복사에너지 유입이 가장 많고 기온이 높은 13:00-14:00에서 측정된 Ts-Ta의 변화는 건조 처리 기간이 경과함에 따라 차이가 커졌으며, 토양수분함량 변화(Figure 1)와 유사하게 나타났다.
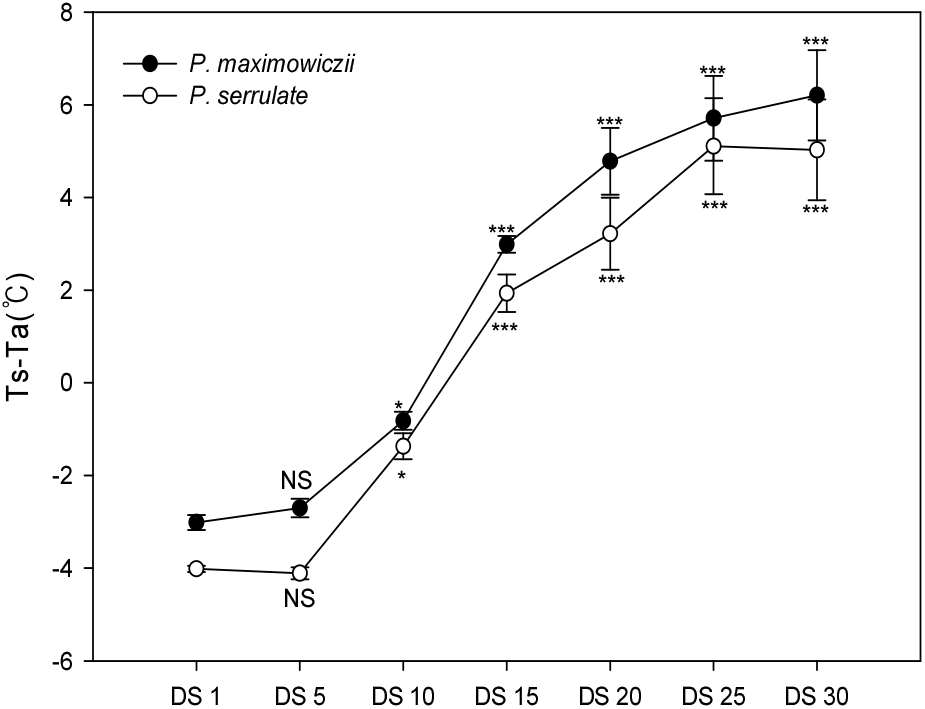
토양수분함량이 11.0% 이상일 때 Ts-Ta의 경우 산개벚나무는 –0.3~-0.8°C, 잔털벚나무는 –0.4~-1.4°C인 반면, 토양수분함량이 10.0~6.0% 일 때 산개벚나무는 3.0~4.8°C, 잔털벚나무는 1.9~2.3°C, 6% 이하일 때 산개벚나무는 5.7~ 6.2°C, 잔털벚나무는 5.1%로 토양수분함량 감소에 따라 유의적으로 엽온이 상승하였다. 토양수분함량 10% 이하에서 엽온이 기온보다 높아지기 시작하여 토양수분 부족이 심화됨에 따라 DS 15일 차에 산개벚나무는 3.0°C, 잔털벚나무는 1.9°C, DS 30일 차에 산개벚나무는 6.2°C, 잔털벚나무는 5.2°C까지 차이를 보였다.
조사시점(13:00-14:00)에서 평균적으로 습도는 88.5%, 일사량은 855.5 W/㎡ 이상으로 증산이 많이 일어날 수 있는 조건임에도 수분이 부족하여 광합성이 정상으로 이루어지지 않아 증산을 통한 잠열냉각 효율이 크게 낮아지는 반면, 잎을 통한 장파복사 방출이 증가하여 엽온이 높아지는 것으로 판단되었다(Kim et al., 2020). 따라서 산개벚나무 및 잔털벚나무는 토양수분함량 부족 시 증산이 억제되고 잠열냉각이 감소하여 정상적인 식물체 내의 열소산이 완전히 이루어지지 않아 엽온 상승을 통한 장파복사 방출로 열소산과정을 수행하는 것으로 판단되었다(Shin et al., 2019).
건조 스트레스(Drought stress, DS) 처리기간에 따른 광합성 특성 및 엽록소 형광반응, 엽온-대기온도차 요인의 영향을 살펴보고자, 이들 요인에 대한 상관분석을 실시하였다(Table 2,3). DS와 엽온-대기 온도차의 상관계수는 산개벚나무의 경우 r2=0.940(p<0.01), 잔털벚나무는 r2=0.913 (p<0.01)으로 유의한 정의 상관관계를 보였다. 이는 복숭아나무의 수분 스트레스 평가를 위해 CWSI(Crop Water Stress Index)와 엽온의 상관계수가 낮 시간대(11-16시) 기준으로 r2=0.99으로 매우 높게 나타난 연구결과와 유사하였다(Yun et al., 2020). DS와 PIABS의 상관계수에서 산개
DS: Drought stress, Pn max: maximum photosynthesis rate, Lcomp: light compensation point, Dresp: dark repiration, and Φ: net apparent quantum yield, E: stomatal transpiration rate, WUE: water use efficiency, fluxes ratios(ΦPO, ΨO, ΦEO), relative activities per reaction center(ABS/RC, TRO/RC, ETO/RC, DIO/RC), PIABS: performance index, Ts-Ta: temperature differences between canopy and air. Means with different letters above each bar indicate significant differences at 5% by Duncan’s Multiple Range Test(DMRT, p<0.05). Vertical bars represent±SD(n=5). Significant difference by Pearson correlation analysis (**p<0.01).
DS: Drought stress, Pn max: maximum photosynthesis rate, Lcomp: light compensation point, Dresp: dark repiration, and Φ: net apparent quantum yield, E: stomatal transpiration rate, WUE: water use efficiency, fluxes ratios(ΦPO,ΨO,ΦEO), relative activities per reaction center(ABS/RC, TRO/RC, ETO/RC, DIO/RC), PIABS: performance index, Ts-Ta: temperature differences between canopy and air. Means with different letters above each bar indicate significant differences at 5% by Duncan’s Multiple Range Test(DMRT, p<0.05). Vertical bars represent±SD(n=5). Significant difference by Pearson correlation analysis (**p<0.01).
벚나무는 r2=–0.967(p<0.01), 잔털벚나무는 r2=–0.947(p< 0.01)을 나타내었고, 산개벚나무는 DS와 DIO/RC의 상관계수는 r2=–0.917(p<0.01), 잔털벚나무는 DS와 ETO/RC의 상관계수는 r2=–0.927(p<0.01)으로 높은 부의 상관계수를 보였다.
또한 건조 스트레스와 광합성 특성과 상관관계를 분석한 결과 DS와 최대 광합성 속도(Pn max)의 상관계수에서 산개벚나무는 r2=–0.835(p<0.01), 잔털벚나무는 r2=–0.807 (p<0.01)이며, DS와 순양자수율(Φ)의 상관계수에서 산개벚나무는 r2=–0.758(p<0.01), 잔털벚나무는 r2=–0.898(p< 0.01)으로 부의 상관을 나타내었다. 이러한 건조 스트레스와 엽온 및 광계Ⅱ 활성의 높은 상관관계는 Yun et al. (2020) 연구에서 CWSI(Crop Water Stress Index)지수는 토양수분스트레스 및 엽온의 영향을 크게 받는 것으로 나타난 결과와 유사했다. 또한 이러한 연구결과는 건조 스트레스에 의한 영향이 육안으로 관찰되지 전에 건조 스트레스의 영향을 조기에 파악하는데 유용하게 이용될 수 있음을 나타내 주고 있다. 특히, Ts-Ta, PIABS, DIO/RC, ETO/RC는 토양수분함량의 감소와 광합성 특성과도 유사하게 나타나, 수목의 건조 스트레스를 예측하는데 있어서 유용한 변수로 활용될 수 있을 것으로 보인다.
결 론
수분공급 중단 DS 10일부터 토양수분함량은 건조한 상태가 되고 DS 15일 이후부터는 토양수분함량이 7.3~8.9%로 위조가 시작되는 조건에 해당되었다. 이에 최대광합성 속도는 DS 10일 이후부터 유의적인 감소추세를 보였으며, 산개벚나무는 토양수분함량 13.6% 이하일 때, 잔털벚나무는 11.4% 이하일 때 광보상점의 감소가 두드려졌다. 또한 산개벚나무는 DS 15일에 토양수분함량이 8.9%일 때, 잔털벚나무는 DS 20일에 토양수분함량이 4.9%일 때 최대광합성 속도, 광보상점, 순양자수율 역시 큰 폭으로 감소한 반면, 수분이용효율은 일시적으로 증가하였다. 엽록소 형광분석 결과, 건조스트레스 초기에는 엽면적당 흡수되는 에너지와 광화학과정으로 포획되는 에너지의 감소가 먼저 나타났으며, 산개벚나무는 DS 15일 이후부터 토양수분함량이 8.0% 이하, 잔털벚나무는 DS 20일 이후부터 토양수분함량이 5%이하 보다 낮아지는 시기부터 전자 전달과정에서 전자 이동의 제한이 두드러지게 되어 전반적으로 광합성 활성의 감소가 나타난 것을 알 수 있었다.
종합적으로 산개벚나무 및 잔털벚나무는 토양수분함량이 감소하는 DS 10일 이후부터 건조 스트레스에 대응하기 위해 최대 광합성속도가 감소되며, 이 시기에 기공닫힘으로 통해 증산량을 감소시켜 수분이용효율을 증가와 수분손실을 줄이려는 반응을 보였다. 그러나 토양수분함량이 10% 이하 수준까지 낮아지면서 광계Ⅱ에서 광계Ⅰ로 전자를 전달하는 과정에서 손실이 많아져 전반적인 광합성 활성이 크게 감소된 것을 알 수 있었다.