Article
기후변화에 따른 특산수종 노각나무의 지리와 지위 중첩 변화 예측
설재원
1, 권혜진
2, 조용찬
3,*
Climate Change-related Prediction of Changes in Geographic and Niche Overlap of Korean Endemic Tree Species Stewartia koreana
Jaewon Seol
1, Hye Jin Kwon
2, Yong Chan Cho
3,*
1Division of Forest Biodiversity Research, Korea National Arboretum, Pochen 11186, Korea
2Division of Garden Plant Resources, Korea National Arboretum, Pochen 11186, Korea
3Gwangneung Forest Conservation Center, Korea National Arboretum, Pochen 11186, Korea
© Copyright 2024 Korean Society of Forest Science. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Sep 02, 2024; Revised: Oct 16, 2024; Accepted: Oct 25, 2024
Published Online: Dec 31, 2024
요 약
기후변화는 생물다양성에 중대한 영향을 미치며, 특히 좁은 생육 범위를 가진 특산식물의 민감성을 증가시킬 수 있다. 본 연구는 특산수종 노각나무의 생육지점 자료(214개 지점)를 활용하여 기후변화 시나리오(SSP1-2.6, SSP3-7.0, SSP5-8.5)를 적용한 6개 알고리듬의 앙상블 모델을 개발하고, 생육적지의 지리, 민감성, 지위 중첩도(Niche overlap)의 변화를 평가하였다. 분석 결과, 현재 노각나무의 지리학적 중심은 온대북부 식생기후대였으며, 생육적지는 시나리오에 따라 고위도, 고해발 지역으로 이동하였다. 노각나무의 생육적합지는 감소할 것으로 예측되었는데, 특히 SSP5-8.5에서는 민감성이 -53%로 나타났다. 노각나무와 다른 식물 사이의 지위중첩도는 감소하는 양상이었다. 종합하면, 기후 고온기(Hypsitermal interval)에 북상한 이후 기후 한랭화에 따라 남쪽으로 후퇴 중인 노각나무는 미래 기후에서 고해발 산지에만 생육적지가 잔존하거나 새롭게 발생하는 기후변화 취약종으로 평가되었다. 생육적지의 소멸 위험성이 높은 남부 및 저해발 산지의 노각나무 집단에 대한 보전 노력이 필요하다.
Abstract
Climate change significantly affects biodiversity, particularly by increasing the vulnerability of endemic plants with narrow habitat ranges. This study used habitat data from 214 locations of the Korean endemic tree Stewartia koreana to develop an ensemble model using six algorithms and three climate change scenarios (SSP1-2.6, SSP3-7.0, and SSP5-8.5). This study evaluated changes in the locations of suitable habitats, sensitivity (Range change index), and niche overlap in these scenarios. Our analysis shows that the current geographical center of S. koreana is in the northern temperate vegetation climate zone. In the three scenarios, the suitable habitats for S. koreana are predicted to shift toward higher latitudes and altitudes, resulting in an overall decrease in suitable areas. The highest sensitivity was observed in the SSP5-8.5 scenario, with a 53% decrease in suitable habitats. Furthermore, the niche overlap with other species decreased, indicating potentially altered interactions between species. In summary, S. koreana moved north during the mid-Holocene hypsithermal interval and is now retreating south due to climate cooling. Owing to the predicted future climate, it is considered a vulnerable species whose habitat remains or is newly occurring only in high-altitude mountainous areas. Conservation efforts are most needed for S. koreana populations in southern and low-altitude mountainous areas where the habitat is at a high risk of disappearing.
Keywords: climate change; Stewartia koreana; range shift; sensitivity; niche overlap
서 론
기후변화와 관련한 지리 지역 및 생물종에 대한 현장 관찰과 생태 모델링 모두는 동일한 멸종 위험성을 나타내지 않는다(Cho et al., 2015; Urban, 2015; Koo, 2016; Román-Palacios and Wiens, 2020; Kim et al., 2024). 기후변화 영향에서 관찰할 수 있는 지역 사이에서, 그리고 생물종 사이에서 발생하는 이러한 차이는 기후변화에 대한 전체적인 지구의 생물다양성 반응을 형성하고 있다(Jeong et al., 2022). 기후변화의 영향을 평가하기 위해 특히 생물종과 군집 수준(생물 상호작용)에 대한 명확한 변화 양상을 끌어내는 것이 중요하다. 이러한 접근은 기후변화가 가져오는 생물다양성에 대한 위험성과 보전 순위를 이해하는데 기여하기 때문이다.
일반적으로 특정 지리 영역(주로 생태 지역과 국가)에만 생육하는 식물로 정의되는 특산식물은 우리나라 생물다양성의 고유성을 형성 및 유지하는 핵심 요소이며(Chung et al., 2017), 이들의 고유한 유전 구성과 생태 지위에 대한 적응력을 이해하는 것은 국가 생물다양성 보전 활동의 기초이다. 하지만 특산생물종은 특수한 좁은 범위의 환경 조건에 대한 적응력으로 인해 멸종에 취약하다(Sheth and Angert, 2014). 이러한 특산생물종의 민감성은 기후변화를 포함한 다양한 환경 위기로 인해 증가하고 있으며, 상당한 수준의 생물다양성 변화를 유발시키고 있는 중요 요인이다(Parmesan, 2006). 따라서 기후변화에 대한 특산생물종의 민감성에 대한 종 단위 및 군집 수준의 평가는 위험 예측과 적응 전략 마련에 필요한 필수 작업이다.
차나무과의 하록교목 노각나무는 조경수와 자원식물로 이용되는 우리나라 특산수종이다(Choi, 1994; Kwon et al., 2008; Kim et al., 2021). 노각나무는 전남과 경남을 중심으로 생육하는 남부 수종이지만, 기후변화 취약종으로 다루지는 않는다(Oh et al., 2010). 노각나무는 남부 수종으로서 온난화를 동반하는 기후변화에 따라 고위도와 고해발 방향 이동을 예상할 수 있다. 권혁수 등(Kwon et al., 2012)은 노각나무의 종분포 모델은 남부 지방의 풍부한 연강수량과 해발고도의 영향이 큰 것으로 보고하였다. 이민철(Lee, 2023)은 기후변화 공통사회경제경로(Shared Socioeconomic Pathways, 이후 SSP)에 따라 노각나무의 생육지가 북상하며 생육범위 역시 증가할 것으로 보고하였다. 노각나무는 고로쇠나무, 들메나무, 함박꽃나무, 산수국, 매화말발도리와 같이 공중습도가 유지되는 계곡과 너덜 식생 인자로 다루어지고 있다(Kwon and Song, 2008). 개체군의 지리학적 변화는 국지적 양상이 존재하며, 특히 특산식물과 같이 입지 환경의 제한을 따르는 생물종은 기후변화에 따른 일관된 변화를 나타내지 않을 수 있다(Thomas, 2010). 또한 종분포 모델링에 활용되는 분포점 자료의 수준, 그리고 적용하는 모델은 예측 결과에 영향을 줄 수 있다.
본 연구는 기후변화 SSP 시나리오와 최신 생육지점 자료를 적용하여 우리나라 남부의 특산수종인 노각나무에 대한 종분포 모델링을 실시하였다. 본 연구의 목적은 1) 노각나무의 생육적합지 분포와 지리적 변화를 이해하고, 2) 기후변화에 대한 민감성, 3) 군집수준의 생물 상호작용 변화를 평가하는데 있다. 이를 통해 우리는 특산식물의 기후변화 민감성에 의한 멸종 위험성 예측과 적응 전략 마련에 필요한 정보를 제공하고자 한다.
방 법
1. 연구 지역
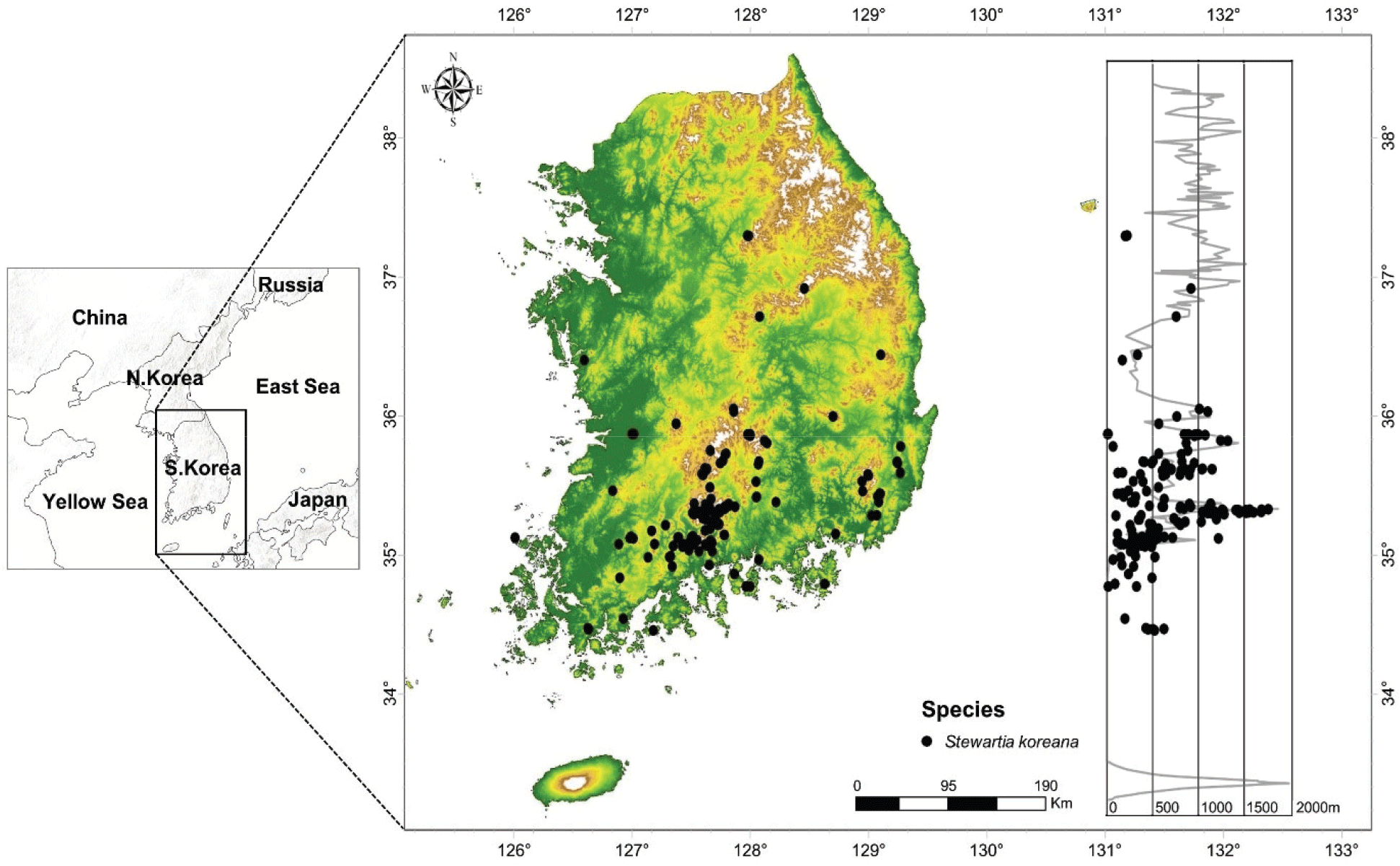
본 연구는 우리나라 남부를 대상으로 수행되었다(N33°~N38°, E125°~131°)(Figure 1). 연구지역은 북쪽으로는 중국과 북한이, 동쪽으로는 동해가, 서쪽으로는 황해가, 남쪽으로는 대한해협이 접해 있다. 우리나라는 산악 지형, 평야, 해안선 등 다양한 지형 요소가 공존하여 다양한 식물군이 생육할 수 있는 환경을 제공한다(Kim et al., 2012; Park, 2014). 한반도의 기후는 대륙성 기후와 해양성 기후가 혼합된 형태로, 북부 지역은 한랭온대(Cold temperate) 기후, 남부 지역은 온난온대(Warm temperate) 기후를 나타내며, 여름과 겨울의 기온 차이가 크다(Park et al., 2019). 한반도는 백두대간을 중심으로 하여 다양하고 복잡한 지질구조를 가지며, 경사가 완만하여 산과 평지의 경계가 불명확해 식물의 시공간적 이동에 유리한 조건을 제공한다(Ministry of Land Infrastructure and Transport, 2016).
Figure 1.
Distribution of Stewartia koreana in South Korea. The map illustrates the geographic distribution of Stewartia koreana in South Korea, with black dots marking the observed locations of the species. The background colors on the map represent elevation: green indicates low-altitude areas, yellow to brown indicates mid-altitude regions, and white signifies high-altitude zones. The accompanying graph on the right shows the frequency of Stewartia koreana occurrences across different elevations, with the x-axis representing elevation(in meters) and the y-axis showing latitude.
Download Original Figure
2. 노각나무 분포점 및 환경변수의 준비
우리는 2002년부터 2023년까지 수집된 식생조사자료에서 추출한 214개의 노각나무 분포점을 사용하였다. 노각나무는 우리나라 남부 지역에서 주로 관찰할 수 있는데, 영남 지역(경상남도 89개, 경상북도 17개, 울산광역시 5개, 부산광역시 2개, 대구광역시 1개)과 호남 지역(전라남도 72개, 전라북도 23개)에 다수 분포한다. 또한, 중부 및 동부 지역인 충청도(충청북도 2개, 충청남도 1개)와 강원도(2개)에도 일부 분포한다. 노각나무는 우리나라의 거의 모든 해발고도에서 생육하며, 고도가 높아질수록 분포 밀도는 감소하는 경향을 보인다(Figure 1).
환경변수는 기준 현재(1981-2010), 근미래(2011-2040), 중미래(2041-2070), 먼미래(2071-2100)에 대한 생물기후학적 지표를 포함하였다. 모델링에 사용한 환경변수는 25개이며, 모든 변수는 250미터의 공간 해상도로 사용하였다(Table 1). 환경변수들은 14개의 생물관련 기후변수(CHELSA v.1.2; www.chelsa-climate.org)(Karger et al., 2017), 8개의 토양변수(Soilgrids database; www.soilgrids.org), 3개의 지형변수(NASA SRTM 90; www.cmr.earthdata.nasa.gov)로 구성되었다.
Table 1.
Relative contributions of environmental variables in the modeling results.
|
Order |
Abbreviation |
Variable Class |
Explanation |
Contribution (%) |
|
1 |
bio4 |
Bioclimatic |
Temperature Seasonality(standard deviation ×100) |
19.2 |
|
2 |
gsp |
Bioclimatic |
Precipitation sum accumulated on all days during the growing season based on TREELIM(Paulsen and Körner, 2014) |
8.1 |
|
3 |
srad |
Topographic |
Surface solar radiation |
7.3 |
|
4 |
ocd |
Soil |
Organic carbon density |
6.4 |
|
5 |
bio3 |
Bioclimatic |
Isothermality(Bio2/Bio7)(×100) |
6.0 |
|
6 |
rough |
Topographic |
Surface roughness |
5.9 |
|
7 |
bio2 |
Bioclimatic |
Mean diurnal air temperature range |
5.3 |
|
8 |
npp |
Bioclimatic |
Net primary productivity |
4.9 |
|
9 |
bio13 |
Bioclimatic |
Precipitation amount of the wettest month |
4.4 |
|
10 |
bio15 |
Bioclimatic |
Precipitation seasonality |
4.2 |
|
11 |
kg5 |
Bioclimatic |
Köppen-Geiger climate classification 5 |
3.4 |
|
12 |
bio14 |
Bioclimatic |
Precipitation amount of the driest month |
3.1 |
|
13 |
kg0 |
Bioclimatic |
Köppen-Geiger climate classification |
2.9 |
|
14 |
cfvo |
Soil |
Volumetric fraction of coarse fragments(>2 mm) |
2.8 |
|
15 |
gst |
Bioclimatic |
Mean temperature of all growing season days based on TREELIM(Paulsen and Körner, 2014) |
2.5 |
|
16 |
kg4 |
Bioclimatic |
Köppen-Geiger climate classification 4 |
2.2 |
|
17 |
phh2o |
Soil |
Soil pH |
2.2 |
|
18 |
sand |
Soil |
Proportion of sand particles(> 0.05/0.063 mm) in the fine earth fraction |
1.5 |
|
19 |
silt |
Soil |
Proportion of silt particles(≥0.002 mm and ≤ 0.05/0.063 mm) in the fine earth fraction |
1.5 |
|
20 |
wavg |
Soil |
Soil water retention(Weighted average) |
1.5 |
|
21 |
bdod |
Soil |
Bulk density of the fine earth fraction |
1.2 |
|
22 |
elev |
Topographic |
Elevation |
1.1 |
|
23 |
kg2 |
Bioclimatic |
Köppen-Geiger climate classification 2 |
1.0 |
|
24 |
soc |
Soil |
Soil organic carbon content in the fine earth fraction |
0.9 |
|
25 |
kg3 |
Bioclimatic |
Köppen-Geiger climate classification 3 |
0.6 |
Download Excel Table
3. 종 분포 모델 구축
모델링은 R 4.3.0(R Core Team, 2023)의 biomod2(Thuiller et al., 2009)를 사용하였고, 6개 알고리듬을 활용하여 앙상블 모델을 구축했다. 적용된 6개 알고리듬은 세 가 지 유형으로 구분된다; 3종류의 머신 러닝 방법 Generalized Additive Models(GBM)(Ridgeway, 1999), Random Forest (RF)(Breiman, 2001), Artificial Neural Networks (ANN)(Ripley, 2007), 2종류의 회귀 방법 Multivariate adaptive regression splines(MARS)(Friedman, 1991), Generalized Additive Models(GAM)(Hastie, 2017), 1종류의 분류 방법 Classification Trees Analysis(CTA)(Breiman et al., 1984)이다. 앙상블 모델에 알고리듬을 포함하는 기준은 ROC 통계 값이 0.7 이상인 경우로 설정하였다(Ureta et al., 2022). 개별 모델의 예측력 검증은 KAPPA(Cohen’s Kappa, Heidke skill score), TSS(True Skill Statistics), ROC(Receiver Operating Characteristics)(Appendix 1)를 사용하였다.
분석에 사용된 자료는 식생조사 자료와 함께 모델 당 1,000개의 무작위 비출현 분포점을 생성하여 구축하였고, 노각나무 출현자료와 비출현자료에 동일한 중요성을 부여하였다. 자료는 자료 간의 공간 자기 상관을 줄이기 위해 2km 반경 내에서 무작위로 하나의 출현 점만을 선택하였다. 모델 개발은 자료의 70%는 훈련용, 나머지 30%는 검증용으로 분할하여 진행하였다. 모든 모델에 대해 5번의 반복 실험을 포함한 내부 교차 검증을 실시하여 알고리즘 선택과 보정을 통해 모델의 견고성과 정확성을 높였다.
4) 노각나무의 지리 변화 및 기후변화 민감성 측정
노각나무의 생물지리학적 기초 성질은 식생기후대 및 식물상 구역에 대한 노각나무의 출현 빈도를 통해 구하였다. 한반도의 생물지리학적 공간은 아열대를 뜻하는 난대(暖帶)를 제외한 온대북부, 온대중부, 온대남부의 3개 식생기후대, 식물상 구역은 온난온대, 상량온대, 연안온난온대, 한랭온대의 4개 식물상 구역을 활용하였다(Jung and Cho, 2020). 노각나무의 생물지리학적 공간에 대한 출현 빈도 계산은 214개의 분포점을 이용하였다.
노각나무의 지리(위도, 경도, 해발고도) 이동은 생산된 현재와 시나리오 별 예측 지도를 활용하여 계산하였다. 노각나무의 생육적지의 범위는 앙상블 모델링 결과에서 출현 확률 90% 이상인 공간으로 설정하였다. 위도, 경도, 해발고도의 지리 요소 별 이동 값은 평균보다 극단 값의 영향을 적게 받는 중앙값으로 계산하였다(Rotenberry and Balasubramaniam, 2020). 이 과정은 현재와 적용된 세 가지 기후변화 시나리오(지속 성장 경로 SSP1-2.6, 불균형 성장 경로 SSP3-7.0, 고속 성장 경로 SSP5-8.5)에서 동일하게 진행하였다.
노각나무의 기후변화 민감성은 생육적지의 변화 특성(증가 또는 감소)을 통해 계산하였다. 기후변화 민감성은 순 생육지 면적 변화를 현재의 생육지 면적(km2 단위)으로 나눈 값을 기반으로 한 분포 변화 지수(Range change index)를 사용하여 계산하였다(Pélissié et al., 2022). 분포 변화 지수가 양수일 때는 순 범위 표면이 증가하고, 음수일 때는 순 범위 표면이 감소함을 의미한다. 예를 들면, -100이면 연구 지역 내에서 해당 종이 살 수 있는 적합한 환경이 완전히 사라졌거나 더 이상 존재하지 않는다는 것을 의미한다. 민감성의 계산 공식은 아래의 식 1과 같다:
여기서 scolonization 은 새로 늘어난 면적을, sextinction 은 사라진 면적을, spresent range area 은 현재 면적을 의미한다.
5) 지위 중첩 변화 분석
노각나무의 지위 중첩 변화 분석은 Schoener의 D를 활용하였으며(Schoener, 1968), 노각나무를 포함한 총 309개 식물종의 분포 모델링 결과값을 이용하였다. 대상 식물종은 특산식물 133종, 북부식물 88종, 남부식물 86종, 북부식물이면서 특산식물인 1종, 남부이면서 특산식물인 1종이다(Appendix 2). 특산식물은 지역 생태계의 고유 특성을 반영하고, 북부와 남부식물은 해당 지역 생태계의 지사 및 지리 특성을 잘 대변하는 요소로 판단하여 분석에 이용하였다. 이용된 309개 식물종은 모두 동일한 종분포 모델링 절차를 거쳐 생육적지 분포도를 생성하였다.
Schoener의 D는 환경공간(Environmental-space)을 구성하여 처리하는 지표로, 두 종 간의 환경 조건의 중첩 정도를 수치적으로 평가한다(Schoener, 1968). 이 지표는 0에서 1 사이의 값을 가지며, 0은 환경적 허용 범위가 겹치지 않음을, 1은 동일한 환경적 선호도를 가짐을 의미한다(Warren et al., 2008; Pélissié et al., 2022). 환경공간은 특정 종의 생육 가능 지역을 환경적 조건을 기반으로 변환하여 표현한 것으로, 생육지의 물리적 위치가 아니라 종이 선호하는 환경적 조건이다(Brown and Carnaval, 2019). 이 환경공간은 환경 변수(위도, 경도, 해발고도)의 통계 값과 분포 변화 지수를 결합하여 구성되었다. 지위 중첩 계산은 각 위치의 100km 범위 내 환경을 기준으로 하였으며, 현재 시기와 세 가지 기후변화 시나리오(SSP1-2.6, SSP3-7.0, SSP5-8.5)의 최종 시기(2071-2100)만을 대상으로 분석하였다. 분석은 R 4.3.0(R Core Team, 2023)에서 'Humboldt' 패키지를 사용하였다(Brown and Carnaval, 2019).
결 과
1. 노각나무의 식물지리학적 성질
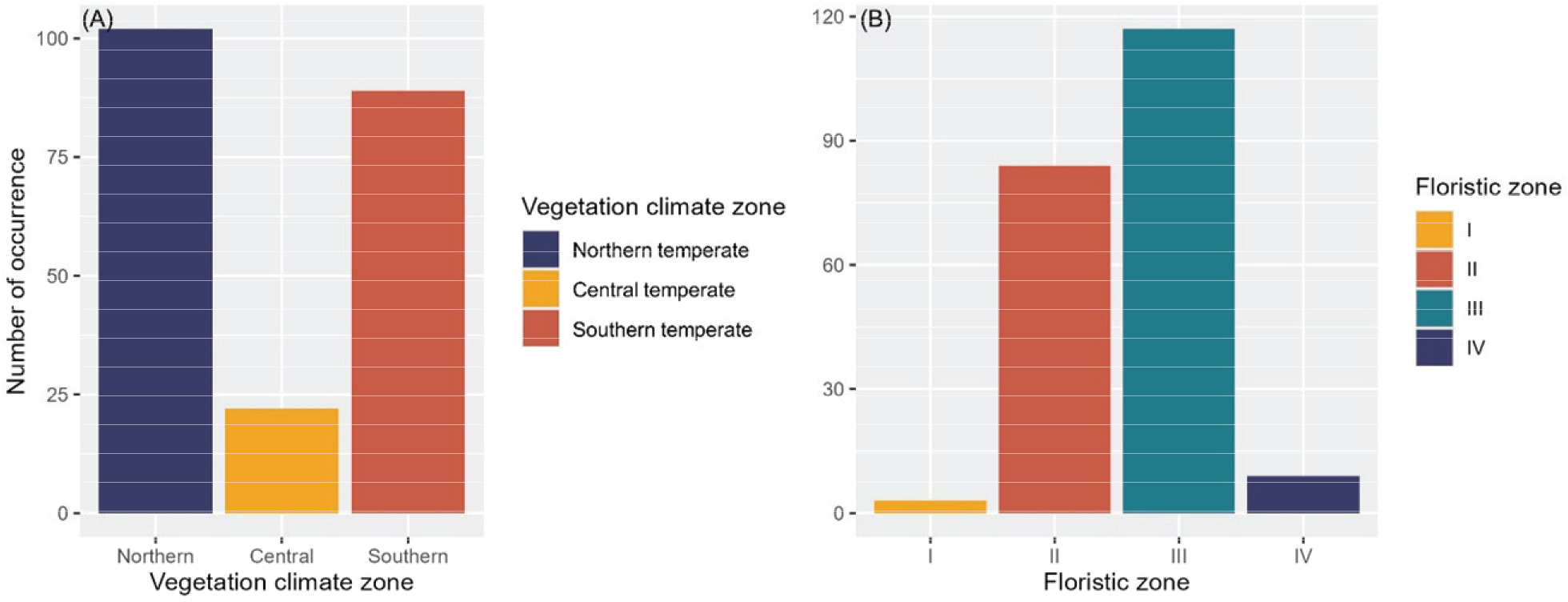
우리나라의 식생기후대에 걸쳐, 노각나무는 온대북부(103개, 48.1%), 온대남부(89개, 41.6%), 온대중부(22개, 10.3%)의 순으로 많이 출현하여 온대북부 식생기후가 주요 생육지로 분석되었다[Figure 2(A)]. 식물상 구역에서, 노각나무는 온난온대 구역에서 118개(55.1%), 상량온대 84개(39.3%), 연안온난온대 9개(4.2%), 한랭온대 3개(1.4%) 순으로 출현 빈도가 높았다[Figure 2(B)].
Figure 2.
Biogeographical characteristics of Stewartia koreana in South Korea. A total of 214 occurrence points of Stewartia koreana were analyzed for frequency and proportion within Northern, Central, and Southern temperate zones, as well as four floristic zones defined by Jung and Cho(2020): Zone I(cold floristic zone in midland high elevation areas), Zone II(cool floristic zone in middle and southern high elevation areas), Zone III(warm floristic zone in middle and southern hilly areas), and Zone IV(maritime floristic zone near coasts and islands). The graphs show occurrences by climatic zone (A) and floristic zone (B).
Download Original Figure
2. 모델에 대한 환경변수의 상대 기여도
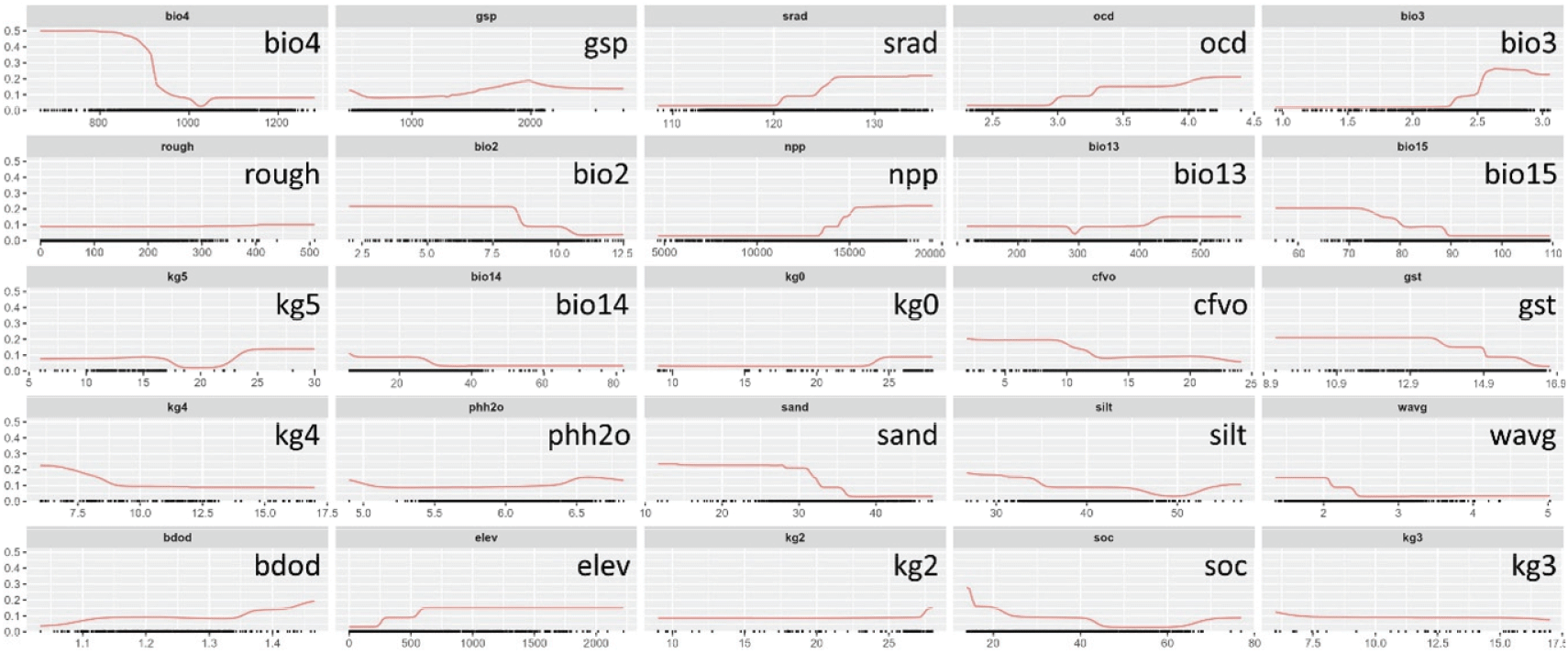
모델링에 활용된 환경변수 중, 기후변수 기온 계절성(bio4)이 19.2%로 가장 높은 기여도를 보였고, 역시 기후변수인 TREELIM을 기준으로 한 생육기 누적 강수량(gsp)이 8.1%, 그리고 지형변수인 표면 일사량(srad)은 7.3%의 기여도를 나타냈다. 토양변수 중에서는 유기 탄소 밀도(ocd)가 6.4%의 기여도를 나타냈다. 그 외의 변수들은 6.0% 이하의 기여도를 보였다(Table 1).
변수 기여도가 가장 높은 기온 계절성(bio4)은 다른 변수에 비해 뚜렷한 반응 곡선을 나타냈고, 생물기후 관련 변수에서 변곡선이 관찰되었다(예, bio3, bio2, bio15)(Figure 3). 지형변수에서는 표면 일사량(srad)에서, 그리고 토양변수 유기 탄소 밀도(ocd)에서 뚜렷한 반응 곡선을 나타냈다.
Figure 3.
Response curves for environmental variables used in the ensemble model, which was generated by combining six algorithms. The x-axis represents the environmental variable values, and the y-axis shows the habitat suitability for Stewartia koreana. The response curves indicate how each environmental factor affects the species' habitat suitability across its range.
Download Original Figure
3. 현재 및 미래 생육적지 예측
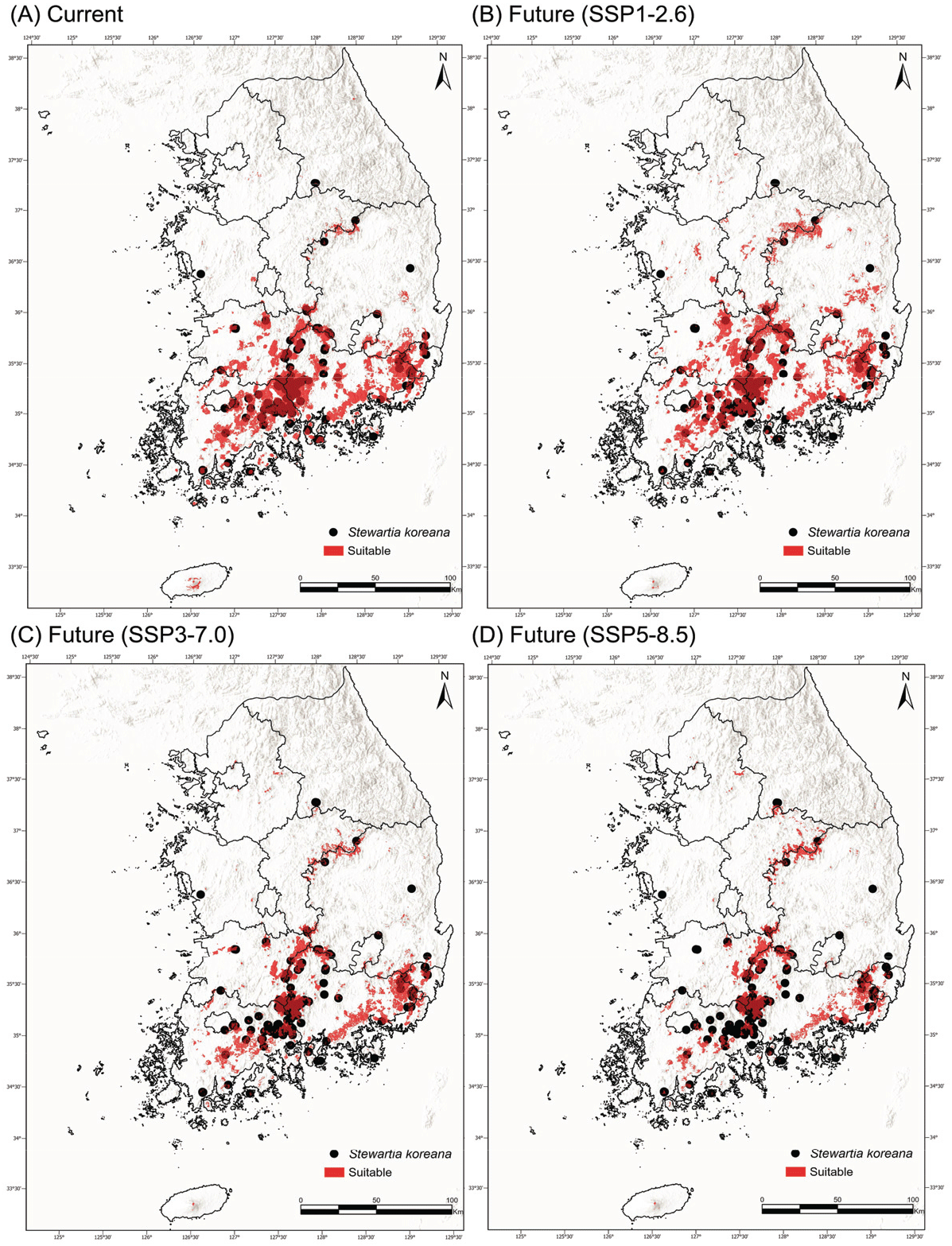
노각나무의 현재 생육 적합지는 전남과 경남이 중심이었으며, 노각나무가 실제 자라지 않는 제주도의 고해발 지역이 포함되는 것으로 예측되었다[Figure 4(A)]. SSP1-2.6를 제외한 모든 시나리오(SSP3-7.0, SSP5-8.5)에서 노각나무의 생육적지는 감소하였으며, SSP5-8.5에서 가장 크게 감소하였다[Figure 4(B), (C) and (D)]. SSP1-2.6에서는 내륙 산악 지역의 생육 적합지가 유지되지만, SSP3-7.0과 SSP5-8.5에서는 감소하여 일부 내륙 산지에 생육적지가 나타났다. 치악산, 소백산, 배재산(보령), 팔공산의 현재 생육 적합지는 제한적이나, 모든 미래 시나리오에서 증가할 것으로 예상되며, 특히 SSP5-8.5에서 크게 확대될 것으로 예측되었다.
Figure 4.
Current and projected potential distribution of Stewartia koreana in South Korea under different SSP scenarios. Panel (A) represents the current distribution, while panels (B), (C), and (D) illustrate the predicted potential distribution for the final period(2071-2100) under SSP1-2.6, SSP3-7.0, and SSP5-8.5 scenarios, respectively. Suitable areas are highlighted in red, and the current distribution points are marked in black.
Download Original Figure
4. 지리 이동, 기후변화 민감성, 지위 중첩도 분석
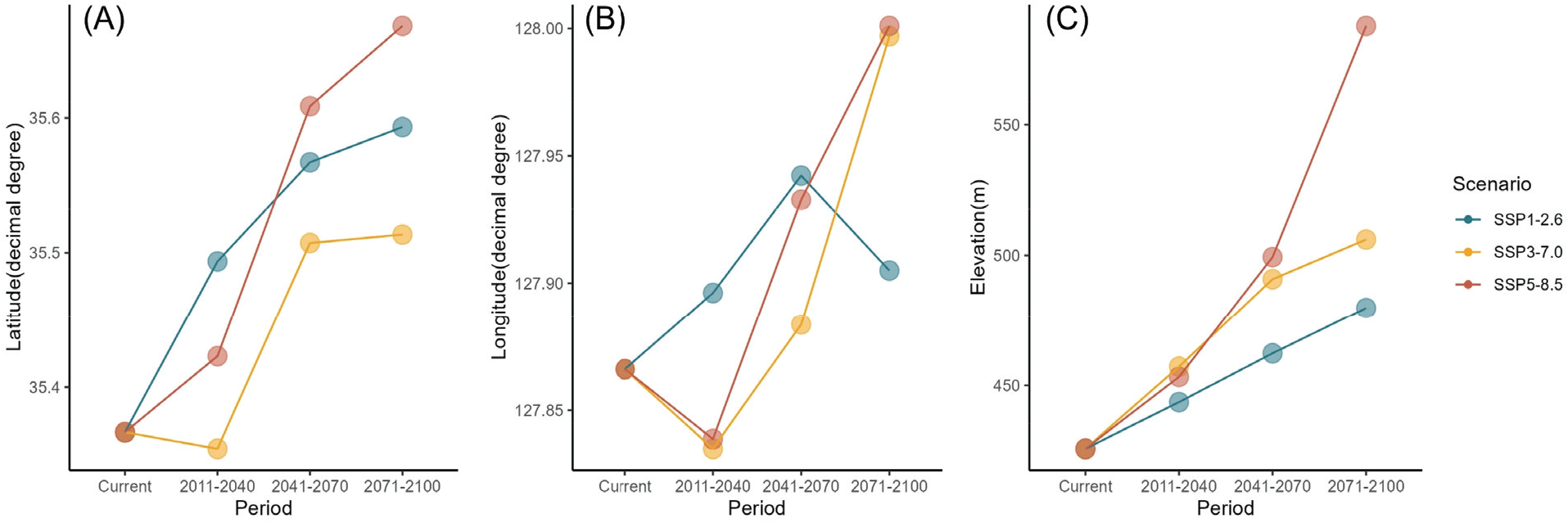
노각나무의 위도 중앙값은 모든 시나리오에서 상승하며, 특히 SSP5-8.5의 최종 시기(2071-2100)에서 가장 큰 변화를 보였다[Figure 5(A)]. 경도 중앙값은 SSP1-2.6에서 시간이 지남에 따라 상승하고, SSP3-7.0와 SSP5-8.5에서는 초기 하락 후 상승하는 양상을 보였다[Figure 5(B)]. 해발고도의 중앙값 또한 모든 시나리오에서 꾸준히 상승하며, SSP5-8.5에서 가장 큰 변화를 보였다[Figure 5(C)].
Figure 5.
Distributional changes of Stewartia koreana by elevation, latitude, and longitude under SSP scenarios. Panel (A) shows changes in latitude, (B) presents shifts in longitude, and (C) depicts changes in elevation. These changes are analyzed under SSP1-2.6, SSP3-7.0, and SSP5-8.5 scenarios, considering four time periods: Current, 2011-2040, 2041-2070, and 2071-2100. The analysis is based on the median values of these changes.
Download Original Figure
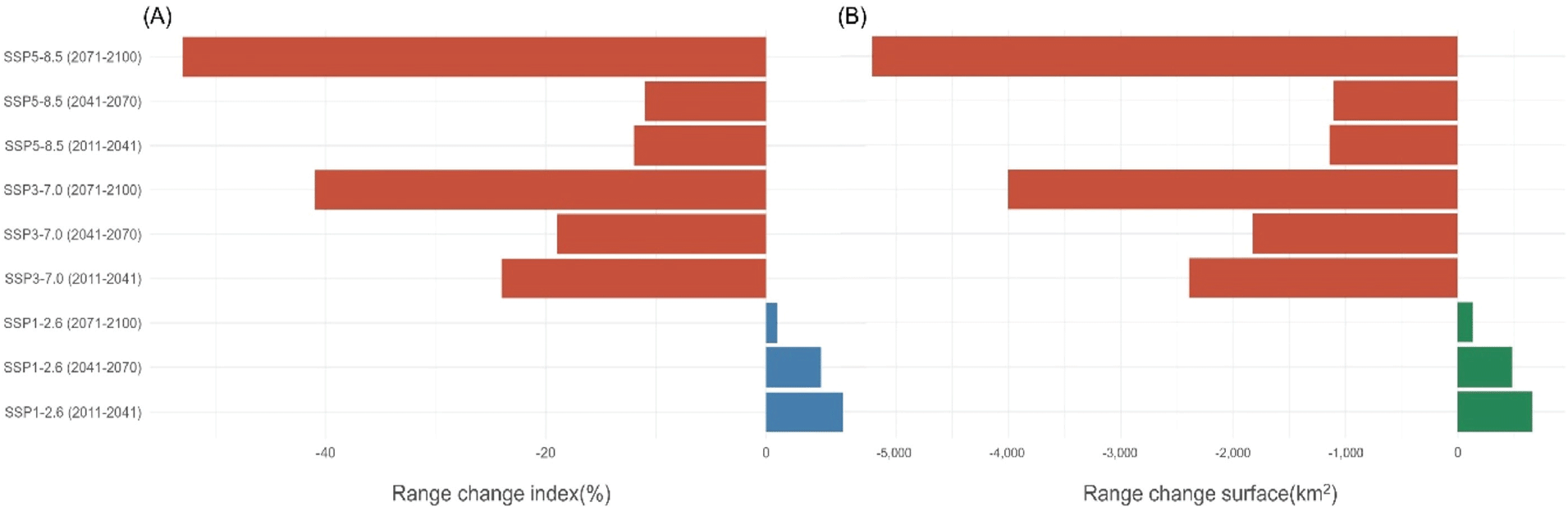
노각나무의 민감성은 SSP1-2.6을 제외한 모든 시나리오와 시기에서 감소하는 것으로 예측되었다(Figure 6). 최종 시기(2071-2100)의 민감성은 SSP5-8.5(RCI=-53), SSP3-7.0 (RCI=-41), SSP1-2.6(RCI=1)의 순으로 낮았다[Figure 6(A)]. 표면적의 변화 역시 민감성과 동일한 양상을 보였다. 최종 시기(2071-2100)의 감소 면적은 SSP5-8.5(-5,213km2), SSP3-7.0(-4,002km2), SSP1-2.6(132km2)의 순으로 낮았다[Figure 6(B)].
Figure 6.
Sensitivity and distribution area changes of Stewartia koreana under different SSP scenarios. Panel(A) illustrates the sensitivity using the Range Change Index(RCI) in percentage, and panel (B) presents the range change surface in square kilometers. Sensitivity is depicted by the red-blue bars on the left, with the range change surface shown by the red-green bars on the right. The data is analyzed under SSP1-2.6, SSP3-7.0, and SSP5-8.5 scenarios across three future periods: 2011-2040, 2041-2070, and 2071-2100.
Download Original Figure
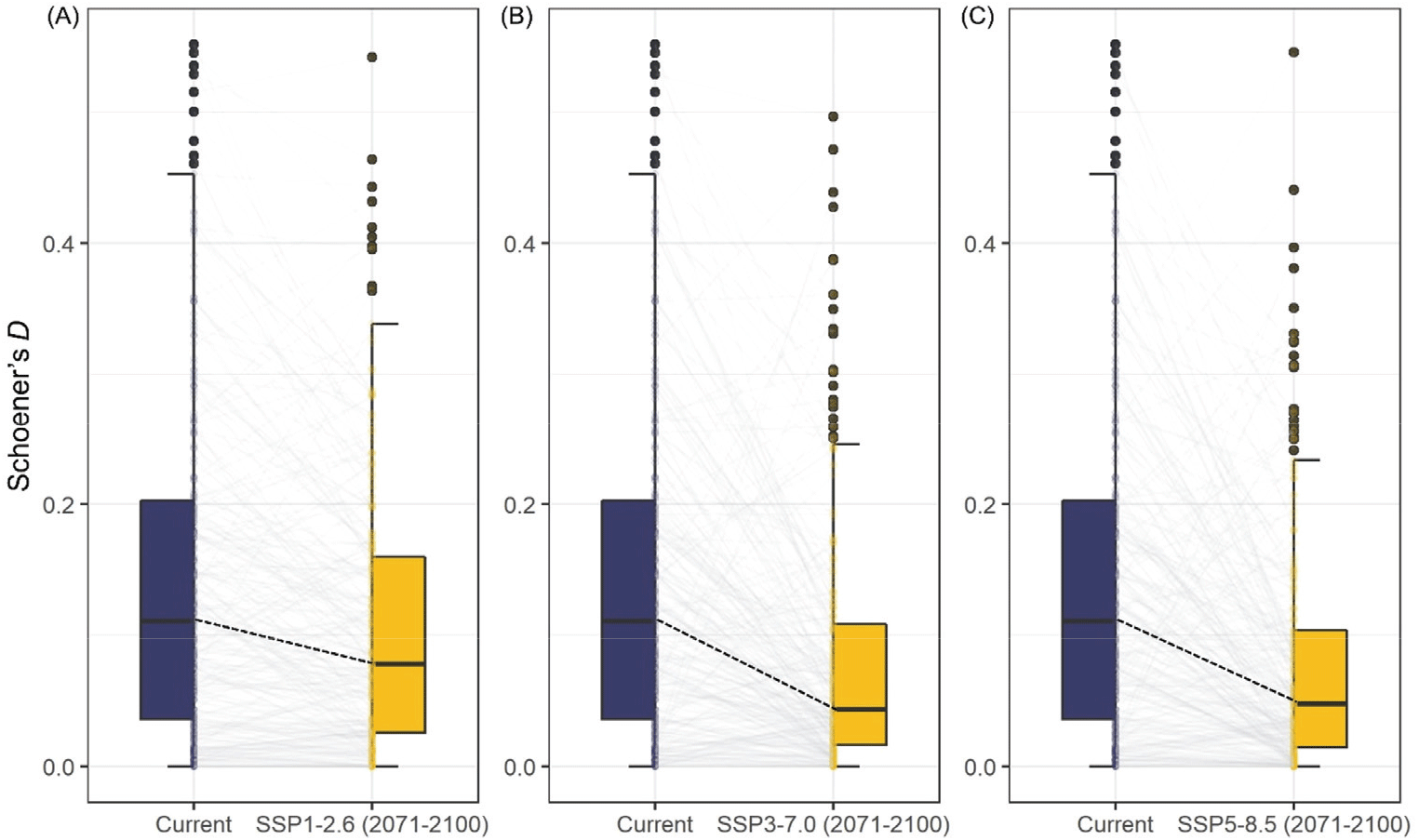
현재와 비교하여 모든 시나리오에서 노각나무의 지위 경쟁을 형성하는 종 수, 그리고 평균 지위 중첩도 모두 감소하였다(Figure 7 and Appendix 2). 현재 시기 노각나무와 309종과의 지위 중첩도는 평균 0.15, SSP1-2.6에서는 307종과 평균 0.12, SSP3-7.0에서는 304종과 평균 0.08, 그리고 SSP5-8.5에서는 301종과 평균 0.08로 분석되었다(Figure 7).
Figure 7.
Niche overlap changes of Stewartia koreana under different SSP scenarios. Schoener's D values, which range from 0(no overlap) to 1(complete overlap), are used to represent niche overlap. Panel (A) shows the overlap between the current period and SSP1-2.6(2071-2100), panel (B) shows the overlap for SSP3-7.0, and panel (C) for SSP5-8.5.
Download Original Figure
현재 시기에서 노각나무와 지위 중첩도가 가장 높은 종은 지리고들빼기(특산식물, D=0.55), 피나물(북부식물, D= 0.55), 털조장나무(남부식물, D=0.54)를 들 수 있다. SSP1-2.6에서는 왕모시풀(남부식물, D=0.54), 아왜나무(남부식물, D=0.50), 둥근배암차즈기(남부식물, D=0.46)가 높은 지위 중첩도를 보였다. SSP3-7.0에서는 둥근배암차즈기(남부식물, D=0.50), 아왜나무(남부식물, D=0.48), 새덕이(남부식물, D=0.43)가 높은 지위 중첩도를 나타냈다. SSP5-8.5에서는 처진물봉선(특산식물, D=0.44), 새끼노루귀(특산식물, D=0.38), 아왜나무(남부식물, D=0.38)가 노각나무와 높은 지위 중첩도를 보였다(Appendix 2).
고 찰
1. 노각나무의 지리
노각나무의 생육지 밀도는 식생기후보다는 등질한 종 조성을 반영하는 식물상 구역의 경사를 따르고 있었다. 일반적으로 식물종의 양적 분포는 기후와 지형을 포함하는 환경 요인의 경사를 따른다(Huang et al., 2021; Maharjan et al., 2022). 과거 기후 고온기 동안 노각나무는 한반도 중부 이북과 고산지역으로 확장되었으며, 이후 기온 하강에 따라 남부와 저해발 지역으로 이동하고 있다(Kim et al., 2014). 이러한 제4기 기후 변동으로 인해 생물종의 서식지가 이동하면서 개체군이 분리되는 현상이 발생할 수 있다(Rahbek et al., 2019). 예를 들면, 빙하기에 남하했던 월귤은 현재 한반도의 고산대에 주로 분포하며, 홍천군의 저지대에 잔존 개체군이 생육하고 있다(Kong and Lim, 2008). 이러한 점에서, 치악산, 소백산, 배재산, 팔공산은 후퇴하는 노각나무 집단의 잔존 개체군으로 다룰 수 있을 것이다(Kim et al., 2014). 따라서 식생기후 경사를 따르지 않는 노각나무의 현재 분포 양상은 기후변동의 영향과 함께 국지적인 개체군 적응의 영향이 존재하는 것으로 판단된다.
노각나무의 현재 분포는 기온 계절성(bio4), 생육기 누적 강수량(gsp), 그리고 표면 일사량(srad)과 같은 환경 요인에 의해 크게 영향을 받는다. 노각나무는 기후 고온기 이후 최근까지 진행되고 있던 한랭화 과정을 따라 남하하면서, 대륙성 기후의 영향이 큰 북부보다는 기온 계절성(bio4)이 900에서 1,000 사이인 한반도 남부 지역에서 주로 생육하고 있다(Figure 3). 영남 지역은 연간 강수량이 부족하고 건조한 기후로 인해 노각나무의 생육지 밀도가 비교적 낮은 것으로 판단된다. 호남 지역은 공중습도가 유지되는 너덜과 같은 입지 조건(Kwon and Song, 2008)과 생육기 동안 충분한 강수량을 갖춘 지역에서 노각나무의 생육지 밀도가 높게 나타난다.
2. 노각나무의 생육적지 이동과 기후변화 민감성
기후변화 시나리오에 따라 노각나무의 생육적지는 현재보다 더 높은 위도와 고해발 지역으로 이동할 것으로 예측되었고, SSP1-2.6를 제외하면, 생육적지가 크게 감소하는 기후변화 취약종으로 평가되었다. 기후변화에 따라 식물종들의 북상(위도 및 해발고도) 현상이 보고되고 있다(Shugart et al., 2003; Lemmen et al., 2004; West and Gawith, 2005; Telwala et al., 2013; Couet et al., 2022). 우리나라에서는 식물종의 실제 이동에 관한 보고는 드문 반면, 종분포 모델링을 이용한 분포 이동 예측이 활발하다. 분석 결과에서, 노각나무의 위도 상승 양상은 소백산 이북 지역으로 잠재적인 생육적지가 새롭게 생성되는 현상과 경남과 전남의 생육적지들이 소멸하는 현상이 동시에 진행되기 때문이다. 그리고 노각나무의 해발고도 중앙값의 상승은 저해발 생육지들이 소멸하기 때문일 것으로 판단된다. Lee(2023)는 생물기후변수를 이용하여 노각나무의 생육적지가 북쪽으로 이동하고 생육지 면적이 증가할 것으로 보고하였다. 본 연구에서는 치악산, 배재산이 포함된 노각나무의 최신 분포 자료, 그리고 생물기후변수와 물리 조건(토양, 지형)과 관련된 환경 변수를 동시에 활용하여 모델링을 실시했기 때문에 기존 연구와 다른 생육적지와 지리의 변화 양상을 나타낸 것으로 판단된다. 따라서 기후변화의 영향은 노각나무의 저지대 생육적지를 먼저 소멸시키고, 잔존하거나 새롭게 형성되는 생육적지들은 고해발 산지에 고립될 것으로 예측되었다.
3. 생태적 지위 중첩도
미래 기후에서 노각나무는 그와 지위 경쟁하는 식물종의 수와 중첩도 모두 감소할 것으로 분석되었다. 이러한 지위 중첩도의 감소는 노각나무가 다른 종들과의 직접적인 경쟁에서 벗어날 수 있다는 긍정적인 측면이 있을 수 있지만, 동시에 생육지 축소와 생태적 고립을 초래할 수 있어 장기적으로 종의 생존에 부정적인 영향을 줄 수도 있다. 기후 변화에 따른 생육지 이동은 노각나무와 경쟁하는 식물종들의 지위 중첩을 감소시키는 주요 요인이 될 수 있으며, 기존 상호작용의 범위를 축소시키는 동시에 새로운 상호작용을 형성할 수 있다(Pélissié et al., 2022). 기후변화로 인해 발생하는 새로운 환경 조건은 기존 종 간 상호작용의 범위와 강도에 큰 영향을 미친다(Tylianakis et al., 2008; Ash et al., 2017; Brown and Carnaval, 2019; Pélissié et al., 2022). 생육 환경의 범위가 좁을수록 여러 종이 제한된 자원을 두고 경쟁하게 되어 지위 중첩이 증가하지만, 생육 범위가 넓어질수록 각 종이 다양한 자원을 활용할 기회가 많아져 지위 중첩이 감소하는 경향이 있다(Pastore et al., 2021).
현재 시기 노각나무는 특산식물인 지리고들빼기와 북부식물인 피나물과 높은 지위 중첩도를 보인다. 이들 식물종은 실제 남부 지역의 중해발과 고해발 산지에서 노각나무와 생육지를 공유하고 있다. SSP1-2.6과 SSP3-7.0에서는 지위 중첩도가 전체적으로 감소하지만, 남부식물종(예, 아왜나무, 둥근배암차즈기)과 노각나무의 높은 지위 중첩도는 남부식물들이 기후변화에 따라 고위도로 이동하거나 고지대로 이동하면서 발생할 수 있다. 이러한 남부 식물종들은 새로운 생육지에서의 생존과 상호작용을 통해 기존 생태계의 구조와 기능에 중요한 변화를 일으킬 수 있다(Pélissié et al., 2022). 또한 이러한 변화는 새로운 경쟁 관계나 지리적 장벽의 영향을 강화하여 종 간 생태적 지위와 역할을 재구성할 수 있다(Viana et al., 2024). 지위 중첩이 새롭게 발생하거나 증가하는 식물종은 소수이며, 분석에 이용된 다수의 식물종들은 미래 기후에서 노각나무와 지위 중첩도가 감소하거나 소멸하기 때문에 평균적인 지위 중첩도는 감소할 수 있다. 따라서 장기적으로 기후변화는 고산 지대를 중심으로 잔존할 수 있는 노각나무의 생태적 고립을 촉진시킬 수 있다.
결 론
본 연구는 기후변화 시나리오와 노각나무의 최신 분포 자료를 활용하여 종분포 모델링을 실시하고, 노각나무의 지리적 특성, 잠재 생육적지의 변화 양상, 그리고 지위 중첩도의 변화 양상을 평가하였다. 기후변화가 노각나무의 생육적지에 미치는 영향을 분석한 결과, 노각나무의 생육적지는 시간이 지남에 따라 고도와 위도가 높은 지역으로 전환될 것으로 예측되었다. 특히 SSP5-8.5 에서는 생육 범위가 크게 축소되며, 저지대와 남부 지역에서의 생육지 소멸이 우려된다. 이로 인해 노각나무는 고해발 산지에 고립될 가능성이 있으며, 특정 식물종들과의 지위 중첩도가 감소하고, 남부 식물종들과의 새로운 상호작용이 발생할 수 있다. 따라서 노각나무의 지속적인 생존을 보장하기 위해 기후변화의 영향을 반영한 종합적인 보전 전략이 필요하다. 예를 들면, 온대남부 식생기후대 노각나무 집단의 생육적지가 먼저 소멸이 할 수 있으므로, 보전 활동의 우선 지역으로 고려할 수 있다.
감사의 글
본 연구는 국립수목원 연구사업(KNA1-2-43-23-1, KNA1-2-32-18-3, KNA1-2-37-20-4)의 지원으로 수행되었습니다.
References
Breiman, L. 2001. Random forests. Machine learning, 45, 5-32.


Breiman, L., Friedman, J.H., Olshen, R.A. and Stone, C.J. 1984. Classification and Regression Trees, Wadsworth, California, USA, 1984.

Brown, J.L. and Carnaval, A.C. 2019. A tale of two niches: methods, concepts, and evolution. Frontiers of Biogeography 11(4).


Cho, S.H., Park, J.y., Park, J.H., Lee, Y.G., Mun, L.m., Kang, S.H., Kim, G.H. and Yun, J.G. 2015. A study for continue and decline of
Abies koreana forest using species distribution model-Focused in Mt. Baekwun Gwangyang-si, Jeollanam-do. Journal of Korean Society of Forest Science 104(3): 360-367.


Choi, M. 1994. Korean Stewartia. Landscaping tree, 20, 25-27.


Chung, G.Y., Chang, K.S., Chung, J.M., Choi, H.J., Paik, W.K. and Hyun, J.O. 2017. A checklist of endemic plants on the Korean Peninsula. Korean Journal of Plant Taxonomy 47(3): 264-288.


Couet, J., Marjakangas, E.L., Santangeli, A., Kålås, J.A., Lindström, Å. and Lehikoinen, A. 2022. Short-lived species move uphill faster under climate change. Oecologia 198(4): 877-888.




Friedman, J.H. 1991. Multivariate adaptive regression splines. The Annals of Statistics 19(1): 1-67.


Hastie, T.J. 2017. Generalized additive models. In: Chambers, J.M. and Hastie, T.J. (Eds.). Statistical Models in S. Routledge, London, U.K.


Huang, E., Chen, Y., Fang, M., Zheng, Y. and Yu, S. 2021. Environmental drivers of plant distributions at global and regional scales. Global Ecology and Biogeography 30(3): 697-709.


Karger, D.N., Conrad, O., Böhner, J., Kawohl, T., Kreft, H., Soria-Auza, R.W., Zimmermann, N.E., Linder, H.P. and Kessler, M. 2017. Climatologies at high resolution for the earth’s land surface areas. Scientific Data 4(1): 1-20.




Kim, H., Kim, E., Lee, S. and Cho, Y.-C. 2024. Abnormal Winter Drought-Induced Transient Dieback of Korean Fir in the Montane Forests of Mt. Jirisan, South Korea. Journal of Plant Biology 67(2): 123-136.


Kim, H.S., Park, M.J., Kim, S.J., Kim, B.K., Park, J., Kim, D. and Cho, S.J. 2021. Antibacterial and Antibiofilm Activities of Leaf Extracts of
Stewartia koreana against Porphyromonas gingivalis. Journal of Life Science 31(3): 330-337.

Kim, J., et al. 2012. Physical geography of Korea. In: Seoul: Seoul National University Press.

Kim, J.S., Chung, J.M., Kim, S.Y., Kim, J.H. and Lee, B.Y. 2014. Phytogeographic study on the Holocene hypsithermal relict plant populations in the Korean peninsula. Korean Journal of Plant Taxonomy 44(3): 208-221.


Kong, W.S. and Lim, J.H. 2008. Disjunctive Distribution of Vaccinium vitis-idaea and Thermal Condition. Journal of the Korean Geographical Society 43(4): 495-510.

Koo, K.A., Kim, J., Kong, W.S., Jung, H. and Kim, G. 2016. Projecting the Potential Distribution of
Abies koreana in Korea Under the Climate Change Based on RCP Scenarios. Journal of the Korea Society of Environmental Restoration Technology 19(6): 19-30.


Kwon, H., Ryu, J., Seo, C., Kim, J., Tho, J., Suh, M. and Park, C. 2012. Climatic and Environmental Effects on Distribution of Narrow Range Plants. Journal of the Korea Society of Environmental Restoration Technology 15(6): 17-27.


Kwon, H.j. and Song, H.k. 2008. Vegetation Structures and Ecological Properties of
Sterwartia koreana Community. Journal of Korean Society of Forest Science 97(3): 296-304.

Kwon, H.j., Song, H.k. and Kim, M.Y. 2008. Taxonomic review of the
Stewartia korearia Nakai ex Rehder (Theaceae). Korean Journal of Plant Taxonomy 38(3): 233-250.


Lee, M.C. 2023. Prediction of the Spatial Distribution for Korean Endemic Plants based on High Resolution Bioclimatic variables: Especially
Abies koreana and
Stewartia koreana. The Korean Geographical Society 184-185.

Maharjan, S.K., Sterck, F.J., Raes, N. and Poorter, L. 2022. Temperature and soils predict the distribution of plant species along the Himalayan elevational gradient. Journal of Tropical Ecology 38(2): 58-70.


Ministry of Land Infrastructure and Transport. 2016. The National Atlas of Korea II. National Geography Information Institute, Suwon, South Korea.

Oh, B.U., Jo, D.G., Ko, S.C., Choi, B.H., Paik, W.K., Chung, G.Y., Lee, Y.M. and Jang, C.G. 2010. 300 Target plants adaptable to climate change in the Korean Peninsula. Korea National Arboretum, Pocheon, South Korea.

Park, S., Park, H., Im, J., Yoo, C., Rhee, J., Lee, B. and Kwon, C. 2019. Delineation of high resolution climate regions over the Korean Peninsula using machine learning approaches. PLoS One 14(10): e0223362.




Park, S.J. 2014. Generality and Specificity of Landforms of the Korean Peninsula, and Its Sustainability. The Korean Geographical Society 49(5): 656-674.

Parmesan, C. 2006. Ecological and Evolutionary Responses to Recent Climate Change. Annual Review of Ecology, Evolution, and Systematics, 37(1), 637-669.


Paulsen, J. and Körner, C. 2014. A climate-based model to predict potential treeline position around the globe. Alpine Botany 124: 1-12.


R Core Team. 2023. R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing, Vienna, Austria. Available from
https://www.R-project.org/.

Ridgeway, G. 1999. The state of boosting. Computing science and statistics 172-181.

Ripley, B.D. 2007. Pattern recognition and neural networks. Cambridge university press, Cambridge, U.K.

Rotenberry, J.T. and Balasubramaniam, P. 2020. Connecting species’ geographical distributions to environmental variables: range maps versus observed points of occurrence. Ecography 43(6): 897-913.


Schoener, T.W. 1968. Sizes of feeding territories among birds. Ecology 49(1): 123-141.


Shugart, H.H., Sedjo, R.A. and Sohngen, B.L. 2003. Forests & Global Climate Change: potential impacts on US forest resources. Pew Center on Global Climate Change, Arlington, U.S.A.

Thomas, C.D. 2010. Climate, climate change and range boundaries. Diversity and Distributions, 16(3), 488-495.


Thuiller, W., Lafourcade, B., Engler, R. and Araújo, M.B. 2009. BIOMOD–a platform for ensemble forecasting of species distributions. Ecography 32(3): 369-373.


Ureta, C., Ramírez-Barahona, S., Calderón-Bustamante, Ó., Cruz-Santiago, P., Gay-García, C., Swingedouw, D., Defrance, D. and Cuervo-Robayo, A.P. 2022. Evaluation of animal and plant diversity suggests Greenland’s thaw hastens the biodiversity crisis. Communications Biology 5(1): 985.




West, C.C. and Gawith, M. 2005. Measuring progress: Preparing for climate change through the UK Climate Impacts Programme. UK Climate Impacts Programme, Oxford, U.K.

Appendix
Appendix 1.
Performance metrics of the ensemble model (EMwmean) using KAPPA, ROC, and TSS evaluation methods for Stewartia koreana distribution. The average sensitivity, specificity, and cutoff values are presented for each evaluation metric
|
Algorithm |
Metric |
Average sensitivity (%) |
Average specificity (%) |
Average cutoff |
|
EMwmean |
KAPPA |
91.0 |
96.4 |
485 |
|
EMwmean |
ROC |
94.8 |
94.1 |
324 |
|
EMwmean |
TSS |
94.8 |
94.2 |
317 |
Download Excel Table
Appendix 2.
List of species used in the analysis of niche overlap changes between Stewartia koreana and other species using Schoener’s D(Schoener, 1968). The table reports Schoener’s D values for the current scenario, alongside projections for each future scenario
|
Family |
Genus |
Species |
Category |
Current |
SSP1-2.6
(2071-2100) |
SSP3-7.0
(2071-2100) |
SSP5-8.5
(2071-2100) |
|
Acanthaceae |
Strobilanthes |
Strobilanthes oliganthus
|
Southern plant |
0.02 |
0.01 |
0.01 |
0.03 |
|
Aceraceae |
Acer |
Acer mandshuricum
|
Northern plant |
0.22 |
0.10 |
0.06 |
0.05 |
|
Aceraceae |
Acer |
Acer triflorum
|
Northern plant |
0.16 |
0.05 |
0.07 |
0.06 |
|
Aceraceae |
Acer |
Acer ukurunduense
|
Northern plant |
0.13 |
0.09 |
0.03 |
0.02 |
|
Amaryllidaceae |
Lycoris |
Lycoris chinensis
|
Endemic plant |
0.16 |
0.25 |
0.11 |
0.19 |
|
Amaryllidaceae |
Lycoris |
Lycoris flavescens
|
Endemic plant |
0.08 |
0.07 |
0.02 |
0.01 |
|
Amaryllidaceae |
Lycoris |
Lycoris sanguinea
|
Southern plant |
0.50 |
0.28 |
0.30 |
0.25 |
|
Anacardiaceae |
Toxicodendron |
Toxicodendron succedaneum
|
Southern plant |
0.38 |
0.37 |
0.25 |
0.24 |
|
Anacardiaceae |
Toxicodendron |
Toxicodendron sylvestre
|
Southern plant |
0.51 |
0.43 |
0.23 |
0.31 |
|
Apiaceae |
Angelica |
Angelica japonica
|
Southern plant |
0.36 |
0.20 |
0.17 |
0.15 |
|
Apiaceae |
Bupleurum |
Bupleurum euphorbioides
|
Northern plant |
0.04 |
0.01 |
0.01 |
0.01 |
|
Apiaceae |
Cicuta |
Cicuta virosa
|
Northern plant |
0.06 |
0.02 |
0.01 |
0.02 |
|
Apiaceae |
Cnidium |
Cnidium japonicum
|
Southern plant |
0.36 |
0.22 |
0.19 |
0.16 |
|
Apiaceae |
Peucedanum |
Peucedanum hakuunense
|
Endemic plant |
0.09 |
0.16 |
0.10 |
0.12 |
|
Apiaceae |
Pternopetalum |
Pternopetalum tanakae
|
Southern plant |
0.09 |
0.12 |
0.11 |
0.05 |
|
Apiaceae |
Sanicula |
Sanicula rubriflora
|
Northern plant |
0.11 |
0.05 |
0.01 |
0.01 |
|
Apiaceae |
Sillaphyton |
Sillaphyton podagraria
|
Endemic plant |
0.03 |
0.02 |
0.16 |
0.27 |
|
Aquifoliaceae |
Ilex |
Ilex × wandoensis
|
Southern plant |
0.30 |
0.17 |
0.09 |
0.07 |
|
Aquifoliaceae |
Ilex |
Ilex wandoensis
|
Endemic plant |
0.01 |
<0.01 |
- |
<0.01 |
|
Araceae |
Arisaema |
Arisaema ringens
|
Southern plant |
0.42 |
0.26 |
0.24 |
0.27 |
|
Araceae |
Pinellia |
Pinellia tripartita
|
Southern plant |
0.09 |
0.15 |
0.07 |
0.11 |
|
Araceae |
Symplocarpus |
Symplocarpus koreanus
|
Northern plant |
0.11 |
0.25 |
0.05 |
0.04 |
|
Araceae |
Symplocarpus |
Symplocarpus nipponicus
|
Northern plant |
0.01 |
0.02 |
0.01 |
0.01 |
|
Araliaceae |
Dendropanax |
Dendropanax trifidus
|
Southern plant |
0.06 |
0.06 |
0.08 |
0.06 |
|
Araliaceae |
Eleutherococcus |
Eleutherococcus divaricatus
|
Endemic plant |
0.27 |
0.17 |
0.09 |
0.07 |
|
Araliaceae |
Oplopanax |
Oplopanax elatus
|
Northern plant |
0.09 |
0.15 |
0.07 |
0.09 |
|
Aristolochiaceae |
Aristolochia |
Aristolochia manshuriensis
|
Northern plant |
0.09 |
0.07 |
0.02 |
0.02 |
|
Aristolochiaceae |
Asarum |
Asarum chungbuensis
|
Endemic plant |
0.17 |
0.14 |
0.03 |
0.05 |
|
Aristolochiaceae |
Asarum |
Asarum koreanum
|
Endemic plant |
0.26 |
0.08 |
0.03 |
<0.01 |
|
Aristolochiaceae |
Asarum |
Asarum maculatum
|
Endemic plant |
0.22 |
0.07 |
0.06 |
0.08 |
|
Aristolochiaceae |
Asarum |
Asarum patens
|
Endemic plant |
0.33 |
0.18 |
0.06 |
0.03 |
|
Asteraceae |
Ainsliaea |
Ainsliaea apiculata
|
Southern plant |
0.41 |
0.22 |
0.12 |
0.14 |
|
Asteraceae |
Artemisia |
Artemisia codonocephala
|
Northern plant |
0.08 |
0.04 |
0.06 |
0.11 |
|
Asteraceae |
Artemisia |
Artemisia rubripes
|
Northern plant |
0.03 |
0.02 |
0.01 |
0.02 |
|
Asteraceae |
Artemisia |
Artemisia sieversiana
|
Northern plant |
0.01 |
0.02 |
0.02 |
0.03 |
|
Asteraceae |
Aster |
Aster danyangensis
|
Endemic plant |
0.04 |
0.02 |
<0.01 |
0.01 |
|
Asteraceae |
Aster |
Aster hayatae
|
Endemic plant |
0.14 |
0.23 |
0.25 |
0.23 |
|
Asteraceae |
Aster |
Aster koraiensis
|
Endemic plant |
0.25 |
0.11 |
0.16 |
0.14 |
|
Asteraceae |
Carpesium |
Carpesium macrocephalum
|
Northern plant |
0.12 |
0.05 |
0.12 |
0.16 |
|
Asteraceae |
Cirsium |
Cirsium pendulum
|
Northern plant |
<0.01 |
0.01 |
0.01 |
0.03 |
|
Asteraceae |
Cirsium |
Cirsium rhinoceros
|
Endemic plant |
0.02 |
0.03 |
0.07 |
0.05 |
|
Asteraceae |
Cirsium |
Cirsium setidens
|
Endemic plant |
0.14 |
0.06 |
0.02 |
0.02 |
|
Asteraceae |
Crepidiastrum |
Crepidiastrum koidzumianum
|
Endemic plant |
0.55 |
0.23 |
0.06 |
0.06 |
|
Asteraceae |
Leontopodium |
Leontopodium coreanum
|
Endemic plant |
0.16 |
0.15 |
0.04 |
0.03 |
|
Asteraceae |
Leontopodium |
Leontopodium leiolepis
|
Endemic plant |
0.05 |
0.07 |
0.09 |
0.08 |
|
Asteraceae |
Parasenecio |
Parasenecio firmus
|
Northern plant |
0.13 |
<0.01 |
<0.01 |
- |
|
Asteraceae |
Parasenecio |
Parasenecio pseudotaimingasa
|
Endemic plant |
0.15 |
0.12 |
0.03 |
0.04 |
|
Asteraceae |
Rhynchospermum |
Rhynchospermum verticillatum
|
Southern plant |
0.04 |
0.04 |
0.08 |
0.06 |
|
Asteraceae |
Saussurea |
Saussurea calcicola
|
Endemic plant |
0.06 |
0.07 |
0.04 |
0.03 |
|
Asteraceae |
Saussurea |
Saussurea chabyoungsanica
|
Endemic plant |
0.07 |
0.10 |
0.17 |
0.23 |
|
Asteraceae |
Saussurea |
Saussurea diamantiaca
|
Endemic plant |
0.18 |
0.11 |
0.02 |
0.01 |
|
Asteraceae |
Saussurea |
Saussurea eriophylla
|
Endemic plant |
0.09 |
0.08 |
0.04 |
0.03 |
|
Asteraceae |
Saussurea |
Saussurea ussuriensis
|
Northern plant |
0.19 |
0.09 |
0.04 |
0.02 |
|
Asteraceae |
Taraxacum |
Taraxacum hallaisanense
|
Endemic plant |
0.02 |
0.02 |
0.02 |
0.02 |
|
Asteraceae |
Tephroseris |
Tephroseris koreana
|
Northern plant |
0.04 |
0.01 |
<0.01 |
<0.01 |
|
Asteraceae |
Wollastonia |
Wollastonia dentata
|
Southern plant |
0.02 |
0.01 |
0.04 |
0.03 |
|
Athyriaceae |
Athyrium |
Athyrium concinnum
|
Endemic plant |
0.23 |
0.11 |
0.02 |
0.02 |
|
Balsaminaceae |
Impatiens |
Impatiens furcillata
|
Endemic plant |
0.26 |
0.40 |
0.28 |
0.44 |
|
Berberidaceae |
Berberis |
Berberis koreana
|
Endemic plant |
<0.01 |
0.05 |
0.01 |
0.01 |
|
Berberidaceae |
Epimedium |
Epimedium koreanum
|
Northern plant |
0.03 |
0.06 |
0.02 |
0.04 |
|
Berberidaceae |
Gymnospermium |
Gymnospermium microrrhynchum
|
Northern plant |
0.01 |
<0.01 |
<0.01 |
<0.01 |
|
Betulaceae |
Ostrya |
Ostrya japonica
|
Southern plant |
0.17 |
0.20 |
0.25 |
0.26 |
|
Boraginaceae |
Argusia |
Argusia sibirica
|
Southern plant |
0.03 |
0.03 |
0.05 |
0.06 |
|
Boraginaceae |
Brachybotrys |
Brachybotrys paridiformis
|
Northern plant |
0.10 |
0.04 |
0.01 |
0.01 |
|
Brassicaceae |
Cardamine |
Cardamine komarovii
|
Northern plant |
0.07 |
0.05 |
0.01 |
0.01 |
|
Campanulaceae |
Adenophora |
Adenophora racemosa
|
Endemic plant |
0.02 |
0.07 |
0.02 |
0.01 |
|
Campanulaceae |
Codonopsis |
Codonopsis pilosula
|
Northern plant |
0.08 |
0.02 |
0.02 |
0.03 |
|
Campanulaceae |
Hanabusaya |
Hanabusaya asiatica
|
Endemic plant |
0.09 |
0.11 |
0.03 |
0.03 |
|
Campanulaceae |
Peracarpa |
Peracarpa carnosa
|
Southern plant |
0.01 |
0.02 |
0.03 |
0.03 |
|
Campanulaceae |
Wahlenbergia |
Wahlenbergia marginata
|
Southern plant |
0.16 |
0.13 |
0.09 |
0.12 |
|
Caprifoliaceae |
Lonicera |
Lonicera caerulea
|
Northern plant |
0.02 |
0.01 |
0.01 |
<0.01 |
|
Caprifoliaceae |
Lonicera |
Lonicera chrysantha
|
Northern plant |
0.19 |
0.11 |
0.02 |
0.05 |
|
Caprifoliaceae |
Lonicera |
Lonicera subsessilis
|
Endemic plant |
0.14 |
0.07 |
0.06 |
0.05 |
|
Caprifoliaceae |
Lonicera |
Lonicera vesicaria
|
Northern plant |
0.02 |
0.03 |
<0.01 |
0.01 |
|
Caprifoliaceae |
Sambucus |
Euscaphis japonica
|
Endemic plant |
0.37 |
0.22 |
0.13 |
0.15 |
|
Caprifoliaceae |
Viburnum |
Viburnum odoratissimum
|
Southern plant |
0.27 |
0.50 |
0.48 |
0.38 |
|
Caprifoliaceae |
Weigela |
Weigela subsessilis
|
Endemic plant |
0.30 |
0.28 |
0.20 |
0.20 |
|
Caprifoliaceae |
Zabelia |
Zabelia biflora
|
Northern plant |
0.12 |
0.11 |
0.07 |
0.04 |
|
Caprifoliaceae |
Zabelia |
Zabelia tyaihyonii
|
Endemic plant |
0.16 |
0.08 |
0.05 |
0.06 |
|
Caryophyllaceae |
Lychnis |
Lychnis wilfordii
|
Northern plant |
0.01 |
0.01 |
0.01 |
0.03 |
|
Caryophyllaceae |
Pseudostellaria |
Pseudostellaria japonica
|
Northern plant |
0.11 |
0.04 |
0.04 |
0.03 |
|
Caryophyllaceae |
Silene |
Silene koreana
|
Northern plant |
0.04 |
0.02 |
0.04 |
0.05 |
|
Chloranthaceae |
Chloranthus |
Chloranthus fortunei
|
Southern plant |
0.48 |
0.29 |
0.25 |
0.23 |
|
Commelinaceae |
Pollia |
Pollia japonica
|
Southern plant |
0.09 |
0.16 |
0.03 |
0.05 |
|
Crassulaceae |
Hylotelephium |
Hylotelephium ussuriense
|
Northern plant |
<0.01 |
- |
- |
- |
|
Crassulaceae |
Phedimus |
Phedimus latiovalifolius
|
Endemic plant |
<0.01 |
0.03 |
0.02 |
0.01 |
|
Cupressaceae |
Thuja |
Thuja koraiensis
|
Northern plant |
0.02 |
0.06 |
0.01 |
0.03 |
|
Cyperaceae |
Carex |
Carex gifuensis
|
Endemic plant |
0.34 |
0.16 |
0.16 |
0.16 |
|
Cyperaceae |
Carex |
Carex okamotoi
|
Endemic plant |
0.41 |
0.40 |
0.30 |
0.25 |
|
Cyperaceae |
Carex |
Carex pseudochinensis
|
Endemic plant |
0.03 |
<0.01 |
0.01 |
0.01 |
|
Dennstaedtiaceae |
Microlepia |
Microlepia strigosa
|
Southern plant |
0.10 |
0.11 |
0.11 |
0.15 |
|
Dipsacaceae |
Dipsacus |
Dipsacus japonicus
|
Northern plant |
0.11 |
0.07 |
0.05 |
0.04 |
|
Dipsacaceae |
Scabiosa |
Scabiosa comosa
|
Northern plant |
0.07 |
0.05 |
0.02 |
0.01 |
|
Dryopteridaceae |
Dryopteris |
Dryopteris fragrans
|
Northern plant |
0.12 |
0.09 |
0.04 |
0.05 |
|
Dryopteridaceae |
Dryopteris |
Dryopteris fuscipes
|
Southern plant |
0.08 |
0.11 |
0.10 |
0.17 |
|
Dryopteridaceae |
Polystichum |
Polystichum lepidocaulon
|
Southern plant |
0.03 |
0.04 |
0.07 |
0.05 |
|
Elaeagnaceae |
Elaeagnus |
Elaeagnus × submacrophylla
|
Southern plant |
0.41 |
0.29 |
0.14 |
0.10 |
|
Equisetaceae |
Equisetum |
Equisetum hyemale
|
Northern plant |
0.02 |
0.01 |
0.04 |
0.04 |
|
Ericaceae |
Rhododendron |
Rhododendron micranthum
|
Northern plant |
0.08 |
0.03 |
0.04 |
0.03 |
|
Ericaceae |
Rhododendron |
Rhododendron sobayakiense
|
Northern plant |
0.36 |
0.43 |
0.36 |
0.30 |
|
Ericaceae |
Vaccinium |
Vaccinium bracteatum
|
Southern plant |
0.39 |
0.26 |
0.23 |
0.27 |
|
Euphorbiaceae |
Euphorbia |
Euphorbia ebracteolata
|
Northern plant |
0.20 |
0.15 |
0.08 |
0.14 |
|
Euphorbiaceae |
Euphorbia |
Euphorbia fauriei
|
Endemic plant |
<0.01 |
0.02 |
0.03 |
0.04 |
|
Euphorbiaceae |
Mallotus |
Mallotus japonicus
|
Southern plant |
0.42 |
0.29 |
0.27 |
0.31 |
|
Euphorbiaceae |
Mercurialis |
Mercurialis leiocarpa
|
Southern plant |
0.03 |
0.03 |
0.04 |
0.03 |
|
Fabaceae |
Caesalpinia |
Caesalpinia decapetala
|
Southern plant |
0.17 |
0.19 |
0.15 |
0.12 |
|
Fabaceae |
Desmodium |
Desmodium caudatum
|
Southern plant |
0.04 |
0.12 |
0.08 |
0.18 |
|
Fabaceae |
Dunbaria |
Dunbaria villosa
|
Southern plant |
0.25 |
0.14 |
0.11 |
0.09 |
|
Fabaceae |
Indigofera |
Indigofera koreana
|
Endemic plant |
0.19 |
0.11 |
0.06 |
0.05 |
|
Fabaceae |
Lathyrus |
Lathyrus quinquenervius
|
Northern plant |
0.15 |
0.16 |
0.07 |
0.11 |
|
Fabaceae |
Lathyrus |
Lathyrus vaniotii
|
Northern plant |
0.21 |
0.14 |
0.02 |
0.02 |
|
Fabaceae |
Lespedeza |
Lespedeza buergeri
|
Endemic plant |
0.28 |
0.20 |
0.12 |
0.14 |
|
Fabaceae |
Maackia |
Maackia fauriei
|
Endemic plant |
0.03 |
0.01 |
- |
0.01 |
|
Fabaceae |
Rhynchosia |
Rhynchosia acuminatifolia
|
Southern plant |
0.47 |
0.15 |
0.03 |
0.08 |
|
Fabaceae |
Rhynchosia |
Rhynchosia volubilis
|
Southern plant |
0.30 |
0.17 |
0.15 |
0.23 |
|
Fabaceae |
Sophora |
Sophora koreensis
|
Endemic plant |
0.08 |
0.17 |
0.07 |
0.10 |
|
Fabaceae |
Vicia |
Vicia angustepinnata
|
Endemic plant |
0.41 |
0.22 |
0.11 |
0.11 |
|
Fabaceae |
Vicia |
Vicia bungei
|
Northern plant |
0.24 |
0.07 |
0.06 |
0.05 |
|
Fabaceae |
Vicia |
Vicia chosenensis
|
Endemic plant |
0.07 |
<0.01 |
<0.01 |
<0.01 |
|
Fabaceae |
Wisteriopsis |
Wisteriopsis japonica
|
Southern plant |
0.27 |
0.21 |
0.15 |
0.13 |
|
Fagaceae |
Castanopsis |
Castanopsis sieboldii
|
Southern plant |
0.22 |
0.32 |
0.17 |
0.13 |
|
Fagaceae |
Fagus |
Fagus multinervis
|
Endemic plant |
0.05 |
0.08 |
0.05 |
0.08 |
|
Fagaceae |
Quercus |
Quercus acuta
|
Southern plant |
0.24 |
0.14 |
0.08 |
0.07 |
|
Fagaceae |
Quercus |
Quercus glauca
|
Southern plant |
0.25 |
0.20 |
0.26 |
0.18 |
|
Fagaceae |
Quercus |
Quercus myrsinifolia
|
Southern plant |
0.29 |
0.08 |
0.06 |
0.05 |
|
Flacourtiaceae |
Idesia |
Idesia polycarpa
|
Southern plant |
0.17 |
0.17 |
0.17 |
0.12 |
|
Fumariaceae |
Corydalis |
Corydalis alata
|
Endemic plant |
0.02 |
0.06 |
0.18 |
0.21 |
|
Fumariaceae |
Corydalis |
Corydalis albipetala
|
Endemic plant |
0.04 |
0.03 |
<0.01 |
<0.01 |
|
Fumariaceae |
Corydalis |
Corydalis decumbens
|
Southern plant |
0.29 |
0.20 |
0.07 |
0.07 |
|
Fumariaceae |
Corydalis |
Corydalis grandicalyx
|
Endemic plant |
0.13 |
0.09 |
0.06 |
0.07 |
|
Fumariaceae |
Corydalis |
Corydalis incisa
|
Southern plant |
0.31 |
0.16 |
0.05 |
0.07 |
|
Fumariaceae |
Corydalis |
Corydalis maculata
|
Endemic plant |
0.12 |
0.06 |
0.02 |
0.02 |
|
Fumariaceae |
Corydalis |
Corydalis misandra
|
Endemic plant |
0.05 |
0.02 |
0.01 |
<0.01 |
|
Fumariaceae |
Corydalis |
Corydalis namdoensis
|
Endemic plant |
0.12 |
0.09 |
0.17 |
0.20 |
|
Fumariaceae |
Corydalis |
Corydalis ohii
|
Endemic plant |
0.15 |
0.13 |
0.06 |
0.08 |
|
Fumariaceae |
Corydalis |
Corydalis turtschaninovii
|
Northern plant |
0.16 |
0.07 |
0.01 |
0.05 |
|
Gentianaceae |
Gentiana |
Gentiana chosenica
|
Endemic plant |
0.03 |
0.02 |
0.05 |
0.05 |
|
Gentianaceae |
Gentiana |
Gentiana jamesii
|
Northern plant |
0.18 |
0.11 |
0.07 |
0.08 |
|
Gentianaceae |
Gentiana |
Gentiana triflora
|
Northern plant |
0.42 |
0.20 |
0.10 |
0.08 |
|
Gentianaceae |
Gentiana |
Gentiana wootchuliana
|
Endemic plant |
0.01 |
0.03 |
0.01 |
<0.01 |
|
Gentianaceae |
Halenia |
Halenia coreana
|
Endemic, Northern plant |
<0.01 |
0.02 |
<0.01 |
- |
|
Geraniaceae |
Geranium |
Geranium knuthii
|
Endemic plant |
0.04 |
0.01 |
<0.01 |
<0.01 |
|
Gleicheniaceae |
Dicranopteris |
Dicranopteris pedata
|
Southern plant |
0.41 |
0.26 |
0.13 |
0.09 |
|
Hamamelidaceae |
Corylopsis |
Corylopsis coreana
|
Endemic plant |
0.07 |
0.09 |
<0.01 |
0.01 |
|
Hamamelidaceae |
Distylium |
Distylium racemosum
|
Southern plant |
0.10 |
0.17 |
0.22 |
0.21 |
|
Iridaceae |
Iris |
Iris koreana
|
Endemic plant |
0.31 |
0.18 |
0.06 |
0.05 |
|
Iridaceae |
Iris |
Iris odaesanensis
|
Northern plant |
0.07 |
0.01 |
0.01 |
0.01 |
|
Iridaceae |
Iris |
Iris rossii
|
Endemic plant |
0.01 |
- |
0.03 |
0.02 |
|
Isoetaceae |
Isoetes |
Isoetes coreana
|
Endemic plant |
0.07 |
0.05 |
0.03 |
0.04 |
|
Juncaceae |
Juncus |
Juncus setchuensis
|
Southern plant |
0.33 |
0.30 |
0.12 |
0.14 |
|
Lamiaceae |
Ajuga |
Ajuga spectabilis
|
Endemic plant |
0.06 |
0.12 |
0.15 |
0.09 |
|
Lamiaceae |
Dracocephalum |
Dracocephalum rupestre
|
Northern plant |
0.08 |
0.05 |
0.04 |
0.03 |
|
Lamiaceae |
Elsholtzia |
Elsholtzia angustifolia
|
Northern plant |
0.06 |
0.03 |
0.02 |
0.01 |
|
Lamiaceae |
Elsholtzia |
Elsholtzia minima
|
Endemic plant |
0.04 |
0.07 |
0.08 |
0.06 |
|
Lamiaceae |
Salvia |
Salvia chanryoenica
|
Endemic plant |
0.08 |
0.07 |
0.02 |
0.02 |
|
Lamiaceae |
Salvia |
Salvia japonica
|
Southern plant |
0.53 |
0.46 |
0.50 |
0.31 |
|
Lamiaceae |
Scutellaria |
Scutellaria pekinensis
|
Endemic plant |
0.05 |
0.01 |
0.04 |
0.05 |
|
Lauraceae |
Actinodaphne |
Actinodaphne lancifolia
|
Southern plant |
0.20 |
0.28 |
0.39 |
0.31 |
|
Lauraceae |
Cinnamomum |
Cinnamomum yabunikkei
|
Southern plant |
0.26 |
0.30 |
0.33 |
0.32 |
|
Lauraceae |
Lindera |
Lindera sericea
|
Southern plant |
0.54 |
0.22 |
0.23 |
0.24 |
|
Lauraceae |
Litsea |
Litsea japonica
|
Southern plant |
0.20 |
0.26 |
0.20 |
0.22 |
|
Lauraceae |
Machilus |
Machilus japonica
|
Southern plant |
0.16 |
0.17 |
0.23 |
0.15 |
|
Lauraceae |
Neolitsea |
Neolitsea aciculata
|
Southern plant |
0.06 |
0.13 |
0.43 |
0.26 |
|
Lauraceae |
Neolitsea |
Neolitsea sericea
|
Southern plant |
0.27 |
0.37 |
0.30 |
0.22 |
|
Liliaceae |
Allium |
Allium dumebuchum
|
Endemic plant |
0.15 |
0.11 |
0.06 |
0.05 |
|
Liliaceae |
Allium |
Allium linearifolium
|
Endemic plant |
0.03 |
0.01 |
- |
<0.01 |
|
Liliaceae |
Allium |
Allium microdictyon
|
Northern plant |
0.11 |
0.06 |
0.03 |
0.03 |
|
Liliaceae |
Allium |
Allium thunbergii
|
Endemic plant |
0.01 |
0.02 |
0.01 |
<0.01 |
|
Liliaceae |
Chamaelirium |
Chamaelirium japonicum
|
Southern plant |
0.29 |
0.17 |
0.07 |
0.06 |
|
Liliaceae |
Heloniopsis |
Heloniopsis koreana
|
Endemic plant |
0.13 |
0.04 |
0.01 |
<0.01 |
|
Liliaceae |
Heloniopsis |
Heloniopsis tubiflora
|
Endemic plant |
0.20 |
0.17 |
0.04 |
0.03 |
|
Liliaceae |
Hemerocallis |
Hemerocallis hakuunensis
|
Endemic plant |
0.19 |
0.12 |
0.06 |
0.06 |
|
Liliaceae |
Hemerocallis |
Hemerocallis taeanensis
|
Endemic plant |
0.01 |
0.01 |
0.01 |
0.01 |
|
Liliaceae |
Hosta |
Hosta minor
|
Endemic plant |
0.21 |
0.24 |
0.17 |
0.15 |
|
Liliaceae |
Lilium |
Lilium cernuum
|
Northern plant |
0.20 |
0.09 |
0.03 |
0.04 |
|
Liliaceae |
Lloydia |
Lloydia triflora
|
Northern plant |
0.12 |
0.02 |
0.01 |
<0.01 |
|
Liliaceae |
Maianthemum |
Maianthemum bicolor
|
Endemic plant |
0.04 |
0.08 |
0.03 |
0.02 |
|
Liliaceae |
Ophiopogon |
Ophiopogon jaburan
|
Southern plant |
0.27 |
0.33 |
0.25 |
0.22 |
|
Liliaceae |
Polygonatum |
Polygonatum acuminatifolium
|
Northern plant |
0.01 |
<0.01 |
<0.01 |
<0.01 |
|
Liliaceae |
Polygonatum |
Polygonatum cryptanthum
|
Southern plant |
0.15 |
0.02 |
0.01 |
0.01 |
|
Liliaceae |
Polygonatum |
Polygonatum grandicaule
|
Endemic plant |
0.18 |
0.04 |
0.08 |
0.07 |
|
Liliaceae |
Polygonatum |
Polygonatum infundiflorum
|
Endemic plant |
0.10 |
0.06 |
0.04 |
0.03 |
|
Liliaceae |
Polygonatum |
Polygonatum stenophyllum
|
Northern plant |
0.10 |
0.05 |
0.01 |
<0.01 |
|
Liliaceae |
Tofieldia |
Iris ensata
|
Endemic plant |
0.28 |
0.17 |
0.09 |
0.08 |
|
Liliaceae |
Trillium |
Trillium camschatcense
|
Northern plant |
0.05 |
0.04 |
0.02 |
0.01 |
|
Menyanthaceae |
Menyanthes |
Menyanthes trifoliata
|
Northern plant |
0.03 |
0.04 |
0.03 |
0.03 |
|
Moraceae |
Ficus |
Ficus erecta
|
Southern plant |
0.35 |
0.27 |
0.12 |
0.09 |
|
Moraceae |
Ficus |
Ficus erectaT
|
Southern plant |
0.13 |
0.11 |
0.08 |
0.06 |
|
Oleaceae |
Abeliophyllum |
Abeliophyllum distichum
|
Endemic plant |
<0.01 |
<0.01 |
- |
- |
|
Oleaceae |
Forsythia |
Forsythia koreana
|
Endemic plant |
0.12 |
0.03 |
0.13 |
0.15 |
|
Oleaceae |
Forsythia |
Forsythia ovata
|
Endemic plant |
0.01 |
0.12 |
0.07 |
0.07 |
|
Oleaceae |
Fraxinus |
Fraxinus chiisanensis
|
Endemic plant |
0.21 |
0.13 |
0.04 |
0.02 |
|
Oleaceae |
Ligustrum |
Ligustrum quihoui
|
Southern plant |
0.46 |
0.20 |
0.09 |
0.08 |
|
Onagraceae |
Chamerion |
Chamerion angustifolium
|
Northern plant |
0.01 |
0.01 |
<0.01 |
<0.01 |
|
Orchidaceae |
Bletilla |
Bletilla striata
|
Southern plant |
0.10 |
0.11 |
0.13 |
0.09 |
|
Orchidaceae |
Cyrtosia |
Cyrtosia septentrionalis
|
Southern plant |
0.06 |
0.03 |
0.04 |
0.04 |
|
Orobanchaceae |
Orobanche |
Orobanche filicicola
|
Endemic plant |
0.01 |
<0.01 |
<0.01 |
<0.01 |
|
Osmundaceae |
Osmunda |
Osmunda claytoniana
|
Northern plant |
0.06 |
0.07 |
0.01 |
0.01 |
|
Papaveraceae |
Coreanomecon |
Coreanomecon hylomeconoides
|
Endemic plant |
0.26 |
0.02 |
<0.01 |
- |
|
Papaveraceae |
Hylomecon |
Hylomecon vernalis
|
Northern plant |
0.55 |
0.41 |
0.26 |
0.18 |
|
Pinaceae |
Abies |
Abies holophylla
|
Northern plant |
0.18 |
0.15 |
0.12 |
0.10 |
|
Pinaceae |
Abies |
Abies koreana
|
Endemic plant |
0.07 |
0.05 |
0.04 |
0.02 |
|
Pinaceae |
Abies |
Abies nephrolepis
|
Northern plant |
0.18 |
0.11 |
0.08 |
0.10 |
|
Pittosporaceae |
Pittosporum |
Pittosporum tobira
|
Southern plant |
0.33 |
0.27 |
0.24 |
0.27 |
|
Poaceae |
Miscanthus |
Miscanthus changii
|
Endemic plant |
0.12 |
0.23 |
0.06 |
0.06 |
|
Polygonaceae |
Aconogonon |
Aconogonon divaricatum
|
Northern plant |
0.14 |
0.03 |
<0.01 |
<0.01 |
|
Polygonaceae |
Aconogonon |
Aconogonon microcarpum
|
Endemic plant |
0.12 |
0.07 |
0.03 |
0.02 |
|
Polygonaceae |
Fallopia |
Fallopia koreana
|
Endemic plant |
0.30 |
0.28 |
0.11 |
0.05 |
|
Polypodiaceae |
Polypodium |
Polypodium sibiricum
|
Northern plant |
<0.01 |
<0.01 |
<0.01 |
<0.01 |
|
Primulaceae |
Androsace |
Androsace cortusifolia
|
Endemic plant |
0.01 |
0.01 |
0.01 |
0.01 |
|
Primulaceae |
Lysimachia |
Lysimachia coreana
|
Endemic plant |
0.15 |
0.01 |
<0.01 |
<0.01 |
|
Primulaceae |
Primula |
Primula farinosa
|
Endemic plant |
0.08 |
0.01 |
0.01 |
0.01 |
|
Pteridaceae |
Coniogramme |
Coniogramme japonica
|
Southern plant |
0.29 |
0.12 |
0.09 |
0.08 |
|
Pteridaceae |
Pteris |
Pteris cretica
|
Southern plant |
0.09 |
0.09 |
0.13 |
0.13 |
|
Pteridaceae |
Pteris |
Pteris multifida
|
Southern plant |
0.44 |
0.30 |
0.29 |
0.19 |
|
Ranunculaceae |
Aconitum |
Aconitum austrokoreense
|
Endemic plant |
0.45 |
0.44 |
0.33 |
0.33 |
|
Ranunculaceae |
Aconitum |
Aconitum chiisanense
|
Endemic plant |
0.23 |
0.13 |
0.05 |
0.03 |
|
Ranunculaceae |
Aconitum |
Aconitum coreanum
|
Northern plant |
0.08 |
0.06 |
0.02 |
0.02 |
|
Ranunculaceae |
Aconitum |
Aconitum pseudolaeve
|
Endemic plant |
0.30 |
0.24 |
0.10 |
0.09 |
|
Ranunculaceae |
Actaea |
Actaea bifida
|
Endemic plant |
0.08 |
0.07 |
0.04 |
0.02 |
|
Ranunculaceae |
Actaea |
Actaea biternata
|
Southern plant |
0.18 |
0.12 |
0.07 |
0.06 |
|
Ranunculaceae |
Actaea |
Actaea japonica
|
Southern plant |
0.15 |
0.09 |
0.10 |
0.10 |
|
Ranunculaceae |
Adonis |
Adonis multiflora
|
Southern plant |
0.01 |
0.03 |
0.03 |
0.04 |
|
Ranunculaceae |
Anemone |
Anemone amurensis
|
Northern plant |
0.04 |
0.01 |
0.02 |
0.02 |
|
Ranunculaceae |
Anemone |
Anemone koraiensis
|
Endemic plant |
0.07 |
0.04 |
0.02 |
0.01 |
|
Ranunculaceae |
Anemone |
Anemone reflexa
|
Northern plant |
0.07 |
0.03 |
0.01 |
0.01 |
|
Ranunculaceae |
Anemone |
Anemone umbrosa
|
Northern plant |
0.02 |
0.01 |
0.01 |
0.02 |
|
Ranunculaceae |
Clematis |
Clematis brachyura
|
Endemic plant |
0.01 |
<0.01 |
<0.01 |
<0.01 |
|
Ranunculaceae |
Clematis |
Clematis fusca
|
Endemic plant |
0.06 |
0.18 |
0.04 |
0.11 |
|
Ranunculaceae |
Clematis |
Clematis serratifolia
|
Northern plant |
0.02 |
0.01 |
<0.01 |
<0.01 |
|
Ranunculaceae |
Clematis |
Clematis trichotoma
|
Endemic plant |
0.16 |
0.13 |
0.05 |
0.06 |
|
Ranunculaceae |
Clematis |
Clematis urticifolia
|
Endemic plant |
0.18 |
0.03 |
0.01 |
<0.01 |
|
Ranunculaceae |
Delphinium |
Delphinium maackianum
|
Northern plant |
0.03 |
0.01 |
0.01 |
<0.01 |
|
Ranunculaceae |
Eranthis |
Eranthis byunsanensis
|
Endemic plant |
0.36 |
0.21 |
0.07 |
0.13 |
|
Ranunculaceae |
Eranthis |
Eranthis stellata
|
Northern plant |
0.22 |
0.15 |
0.03 |
0.01 |
|
Ranunculaceae |
Hepatica |
Hepatica insularis
|
Endemic plant |
0.13 |
0.36 |
0.39 |
0.38 |
|
Ranunculaceae |
Megaleranthis |
Megaleranthis saniculifolia
|
Endemic plant |
0.12 |
0.13 |
0.04 |
0.03 |
|
Ranunculaceae |
Ranunculus |
Ranunculus crucilobus
|
Endemic plant |
0.06 |
0.09 |
0.02 |
0.02 |
|
Ranunculaceae |
Ranunculus |
Ranunculus franchetii
|
Northern plant |
0.19 |
0.10 |
0.04 |
0.03 |
|
Ranunculaceae |
Thalictrum |
Thalictrum actaeifolium
|
Endemic plant |
0.17 |
0.05 |
0.10 |
0.08 |
|
Ranunculaceae |
Thalictrum |
Thalictrum ichangense
|
Northern plant |
0.23 |
0.09 |
0.15 |
0.17 |
|
Rhamnaceae |
Berchemia |
Berchemia floribunda
|
Southern plant |
0.01 |
<0.01 |
<0.01 |
- |
|
Rhamnaceae |
Rhamnus |
Rhamnus taquetii
|
Endemic plant |
0.01 |
0.03 |
0.03 |
0.03 |
|
Rhamnaceae |
Sageretia |
Sageretia thea
|
Southern plant |
0.14 |
0.03 |
0.04 |
0.04 |
|
Rosaceae |
Filipendula |
Filipendula formosa
|
Endemic plant |
0.41 |
0.28 |
0.11 |
0.05 |
|
Rosaceae |
Fragaria |
Fragaria nipponica
|
Endemic plant |
0.10 |
0.21 |
0.13 |
0.10 |
|
Rosaceae |
Neillia |
Neillia uekii
|
Northern plant |
0.01 |
<0.01 |
<0.01 |
<0.01 |
|
Rosaceae |
Potentilla |
Potentilla centigrana
|
Northern plant |
0.16 |
0.08 |
0.01 |
0.02 |
|
Rosaceae |
Prunus |
Prunus choreiana
|
Endemic plant |
0.01 |
0.02 |
0.03 |
0.02 |
|
Rosaceae |
Prunus |
Prunus glandulifolia
|
Northern plant |
0.12 |
0.12 |
0.04 |
0.06 |
|
Rosaceae |
Prunus |
Prunus ishidoyana
|
Endemic plant |
0.15 |
0.13 |
0.01 |
0.01 |
|
Rosaceae |
Pyrus |
Pyrus hakunensis
|
Endemic plant |
0.06 |
0.10 |
0.10 |
0.07 |
|
Rosaceae |
Rhaphiolepis |
Rhaphiolepis indica
|
Southern plant |
0.24 |
0.09 |
0.07 |
0.06 |
|
Rosaceae |
Rosa |
Rosa acicularis
|
Northern plant |
0.04 |
0.02 |
0.01 |
0.03 |
|
Rosaceae |
Rosa |
Rosa spinosissima
|
Northern plant |
<0.01 |
<0.01 |
<0.01 |
<0.01 |
|
Rosaceae |
Rubus |
Rubus corchorifolius
|
Southern plant |
0.39 |
0.23 |
0.24 |
0.20 |
|
Rosaceae |
Rubus |
Rubus hirsutus
|
Southern plant |
0.30 |
0.18 |
0.13 |
0.10 |
|
Rosaceae |
Rubus |
Rubus hongnoensis
|
Endemic plant |
0.07 |
0.34 |
0.27 |
0.33 |
|
Rosaceae |
Rubus |
Rubus schizostylus
|
Endemic plant |
0.19 |
0.14 |
0.19 |
0.15 |
|
Rosaceae |
Rubus |
Rubus tozawae
|
Endemic plant |
0.02 |
0.06 |
0.09 |
0.09 |
|
Rosaceae |
Spiraea |
Spiraea salicifolia
|
Northern plant |
0.11 |
0.06 |
0.01 |
0.01 |
|
Rosaceae |
Spiraea |
Spiraea trichocarpa
|
Northern plant |
0.05 |
0.03 |
0.01 |
0.02 |
|
Rosaceae |
Waldsteinia |
Waldsteinia ternata
|
Northern plant |
0.03 |
0.06 |
0.04 |
0.07 |
|
Rubiaceae |
Damnacanthus |
Damnacanthus indicus
|
Southern plant |
0.05 |
0.04 |
0.06 |
0.07 |
|
Rubiaceae |
Galium |
Galium koreanum
|
Endemic plant |
0.36 |
0.16 |
0.13 |
0.15 |
|
Rubiaceae |
Galium |
Galium verum
|
Endemic plant |
0.26 |
0.23 |
0.15 |
0.12 |
|
Rubiaceae |
Rubia |
Rubia pubescens
|
Endemic plant |
0.12 |
0.17 |
0.05 |
0.04 |
|
Rutaceae |
Zanthoxylum |
Zanthoxylum ailanthoides
|
Southern plant |
0.13 |
0.20 |
0.22 |
0.27 |
|
Salicaceae |
Populus |
Populus × tomentiglandulosa
|
Endemic plant |
0.11 |
0.08 |
0.09 |
0.09 |
|
Saxifragaceae |
Astilboides |
Astilboides tabularis
|
Northern plant |
0.06 |
0.06 |
0.06 |
0.06 |
|
Saxifragaceae |
Chrysosplenium |
Chrysosplenium barbatum
|
Endemic plant |
0.21 |
0.10 |
0.04 |
0.03 |
|
Saxifragaceae |
Chrysosplenium |
Chrysosplenium flaviflorum
|
Endemic plant |
0.02 |
<0.01 |
<0.01 |
- |
|
Saxifragaceae |
Deutzia |
Deutzia paniculata
|
Endemic plant |
0.18 |
0.21 |
0.08 |
0.10 |
|
Saxifragaceae |
Kirengeshoma |
Kirengeshoma koreana
|
Endemic plant |
0.06 |
0.08 |
0.03 |
0.01 |
|
Saxifragaceae |
Micranthes |
Micranthes nelsoniana
|
Northern plant |
0.25 |
0.10 |
0.05 |
0.14 |
|
Saxifragaceae |
Micranthes |
Micranthes octopetala
|
Endemic plant |
0.07 |
0.04 |
<0.01 |
0.01 |
|
Saxifragaceae |
Mukdenia |
Mukdenia rossii
|
Northern plant |
0.08 |
0.07 |
0.01 |
0.01 |
|
Saxifragaceae |
Rodgersia |
Rodgersia podophylla
|
Northern plant |
0.04 |
0.02 |
0.01 |
0.01 |
|
Schisandraceae |
Kadsura |
Kadsura japonica
|
Southern plant |
0.12 |
0.15 |
0.16 |
0.22 |
|
Schisandraceae |
Schisandra |
Schisandra repanda
|
Southern plant |
0.01 |
0.02 |
0.03 |
0.04 |
|
Scrophulariaceae |
Euphrasia |
Euphrasia coreana
|
Endemic plant |
0.02 |
0.02 |
0.04 |
0.03 |
|
Scrophulariaceae |
Melampyrum |
Melampyrum setaceum
|
Endemic plant |
0.13 |
0.01 |
<0.01 |
- |
|
Scrophulariaceae |
Paulownia |
Paulownia coreana
|
Endemic plant |
0.12 |
0.06 |
0.04 |
0.03 |
|
Scrophulariaceae |
Pedicularis |
Pedicularis hallaisanensis
|
Endemic plant |
0.01 |
0.02 |
0.02 |
0.03 |
|
Scrophulariaceae |
Pedicularis |
Pedicularis ishidoyana
|
Endemic plant |
0.15 |
0.09 |
0.03 |
0.10 |
|
Scrophulariaceae |
Pseudolysimachion |
Pseudolysimachion kiusianum
|
Endemic plant |
0.01 |
0.03 |
<0.01 |
<0.01 |
|
Scrophulariaceae |
Pseudolysimachion |
Pseudolysimachion pyrethrinum
|
Endemic plant |
0.18 |
0.08 |
0.09 |
0.09 |
|
Scrophulariaceae |
Scrophularia |
Scrophularia koraiensis
|
Endemic plant |
0.36 |
0.27 |
0.11 |
0.10 |
|
Scrophulariaceae |
Veronicastrum |
Veronicastrum sibiricum
|
Northern plant |
0.08 |
0.07 |
0.02 |
0.01 |
|
Solanaceae |
Scopolia |
Scopolia parviflora
|
Endemic, Southern plant |
0.17 |
0.09 |
0.02 |
0.01 |
|
Taxaceae |
Taxus |
Taxus caespitosa
|
Northern plant |
0.03 |
0.14 |
0.04 |
0.04 |
|
Theaceae |
Cleyera |
Cleyera japonica
|
Southern plant |
0.38 |
0.24 |
0.11 |
0.08 |
Download Excel Table