서 론
기후변화는 지구 온난화와 강수 패턴 변화를 통해 전 세계 농업과 임업에 심각한 영향을 주고 있다(IPCC, 2011). 특히, 평균 온도 상승과 가뭄 빈도의 증가는 재배되는 임산물과 농작물의 생산성과 생태계를 위협할 뿐만 아니라, 생리적 및 형태적 특성을 변화시켜 작물의 생존과 품질에 중대한 영향을 주게 된다(Kwak et al., 2024). 특히, 건조 스트레스는 식물 생장과 발달, 생산성에 주요한 제약 요인으로 작용하고 있다(Zhao and Running, 2010; Fischer et al., 2002). 건조 스트레스는 식물이 처한 생태적 틈새에서 종의 분포를 크게 변화시키며, 수확량을 제한하는 주요 원인으로 알려져 있다. 예를 들어, 주요 식물에서 건조는 세포 대사 활동과 생물학적 기능을 변화시켜 정상적인 생장과 발달을 방해하고 생산성을 저하시킨다(Farooq et al., 2009; Hu et al., 2023).
지난 수십 년 동안 주요 가뭄 현상이 기록되었으며 아시아를 포함한 많은 지역에서 심화될 것으로 예상되고 있다(Daryanto et al., 2016). 지난 35년 동안 건조 스트레스는 재배 식물의 생산량을 20~60%까지 감소시켰으며, 이는 전 세계적인 식량 안보와 경제적 안정에 심각한 영향을 미쳤다(Daryanto et al., 2016; Khan et al., 2016). 유엔식량농업기구(Food and Agriculture Organization of the United Nations, FAO)의 보고에 따르면, 가뭄은 옥수수의 생산량을 최대 80%까지 감소시킬 수 있으며(FAO, 2020), 이는 건조 스트레스가 생산성에 미치는 심각한 영향을 나타낸다. 이러한 상황은 미래 기후변화 시나리오에서 더욱 악화될 것으로 예상된다. 국제응용시스템분석연구소(International Institute for Applied Systems Analysis, IIASA)의 연구에 따르면, 21세기 말까지 기후변화로 인해 현재 농경지의 최대 40%가 재배에 부적합해질 것으로 예측된다(Fischer et al., 2002).
기후변화는 토양수분 부족을 초래하여 농업과 임업의 생산성과 재배 적합 지역에 심각한 영향을 미칠 것으로 예상된다. 전 세계적으로 기온 상승, 강수 패턴 변화, 증발산량 증가, 고온 기간 연장은 가뭄 조건을 더욱 빈번하고 심각하게 만들고 있다(IPCC, 2021). 이로 인해 과거에 재배에 적합했던 지역이 부적합해지거나, 반대로 건조 지역이 새로운 재배 가능 지역으로 변할 가능성이 증가하고 있다(Parry et al., 2007; Zhao and Running, 2010).
식물의 생리적 반응은 건조 스트레스의 강도와 지속 시간에 따라 달라지며, 이는 수분 제한 조건에서 식물의 적응 전략을 규명하는 데 중요한 정보를 제공한다. 예를 들어, 식물이 토양 수분의 부족 및 건조 스트레스에 노출되면 구조적으로 다양한 형태적인 변화가 나타나게 된다. 식물이 건조한 환경에 지속적으로 노출되게 되면 세포의 생장 감소와 체세포분열 과정의 손상으로 인하여 생장의 감소 및 잎의 노화가 나타난다(Anjum et al., 2017). 이와는 달리, 온화한 토양 수분 스트레스 조건에서는 식물이 단기간 동안 광합성과 세포 팽창을 유지하며 꾸준한 생장을 보장할 수 있지만, 경미하거나 심한 건조 스트레스에서는 광합성 감소, 기공 폐쇄, 잎 크기 감소 등이 관찰되며 생장이 억제된다(Hasanuzzaman et al., 2013; Joshi et al., 2013). 이러한 생리적 변화는 수분 손실을 최소화하고 제한된 자원을 보다 효율적으로 이용하기 위한 식물의 적응 전략으로 볼 수 있다.
황기(Astragalus membranaceus)는 한국 북서부를 포함한 아시아 지역에서 재배되는 중요한 전통 약용작물로, 건조 환경에 대한 생리적 적응 능력과 약리학적 성분의 풍부함으로 주목받고 있다(Zhang et al., 2011; Fu et al., 2014). 그러나 기후변화에 따른 온도 상승과 가뭄 빈도의 증가는 황기의 주요 재배 적지를 감소시키고 생산성을 저하시킬 우려가 크다. 특히, 건조 스트레스는 황기의 광합성 능력 감소와 지상부 생장 저해를 유발하며, 이는 토양 수분 부족 조건에서 더욱 두드러질 수 있다(Kramer and Boyer, 1995; Eziz et al., 2017). 이러한 상황은 황기의 재배 적지 변화와 토양 건조에 따른 생산성 저하의 위험성을 시사하며, 최근 들어, 기후변화의 영향을 체계적으로 이해하고 대응 방안을 마련할 필요성이 강조되고 있다. 특히, 황기의 주요 약리학적 성분인 astragaloside와 calycosin은 항염증, 항산화, 면역 조절과 같은 다양한 생리적 효과를 가지고 있으며, 이는 생태계 회복과 지역 경제 발전에 중요한 역할을 할 수 있다(Fu et al., 2014).
기후변화와 이로 인한 환경 스트레스의 증가는 농업 및 산림생태계의 지속 가능성에 중요한 영향을 미치고 있다. 특히, 건조 스트레스는 식물의 생리적 및 생화학적 과정에 깊은 영향을 미치며, 광합성 감소, 생장 억제, 그리고 2차 대사산물 함량 변화와 같은 다양한 반응을 유발한다(Anjum et al., 2011). 이러한 변화는 약용식물의 약리학적 가치와 경제적 중요성에 큰 영향을 미칠 수 있다. 건조 스트레스가 황기의 생리적 반응과 주요 약리학적 성분에 미치는 영향을 이해하는 것은 이 식물의 약리적 가치를 극대화하고 재배 최적화를 위한 기초 자료를 제공하는 데 필수적이다. 본 연구는 건조 스트레스가 황기의 생리적 반응, 구조적으로 형태학적 변화, 그리고 주요 약리학적 성분 함량에 미치는 영향을 체계적으로 분석하여, 변화하는 환경에서도 안정적인 황기 생산과 약리적 활용성을 유지하기 위한 실질적인 정보를 제공하고자 한다. 특히, 황기의 주요 생리 및 약리적 반응이 건조 스트레스 강도에 따라 어떻게 달라지는지 규명함으로써, 지속 가능한 농업 및 약용식물 재배 시스템 설계를 위한 과학적 기반을 마련하는 데 기여할 것이다.
재료 및 방법
본 연구는 콩과(Fabaceae)에 속하는 다년생 약용식물인 황기(Astragalus membranaceus)를 대상으로 수행되었다. 실험에 사용된 황기 묘는 종자를 파종한 후 70일간 육묘 과정을 거쳐 준비되었으며, 이 과정에서 지상부의 신장이 50~60cm에 도달한 개체를 선별하여 실험에 사용하였다. 실험에 들어가기 전 모든 실험 식물은 9L의 원예용 상토로 채워진 플라스틱 포트에 옮겨 심은 뒤 자연광형 인공기상실(Phytotron, Koito Industries, Yokohama, Japan: 1.5m×1.5m×2.0m) 내에서 7일 동안 순응시켰다. 온도는 주간 25°C, 야간 20°C, 습도는 상대습도 50~60%로 조절되었다.
관수 처리는 대조구(C)와 두 개의 처리구(T1, T2)로 구성된 세 가지 조건에서 진행되었다. 대조구(C)는 포장용수량 수준으로 충분한 수분이 공급된 조건으로 설정하였으며, 처리구는 건조 스트레스 조건에 따라 토양유효수분함량의 차이에 기반하여 T1(50~55%)과 T2(20~25%)로 설정되었다. 각 처리구별로 15개체를 실험에 이용하였으며, 실험은 황기 묘의 정식 후 8주간 건조 스트레스 처리를 시행하였다. 건조 처리 종료 후에는 지상부와 지하부를 수확하여 생장 특성을 조사하였으며, 생체중, 건물중, 수분 함량 측정은 농촌진흥청 식물체 분석법에 따라 수행되었다(Figure 1).
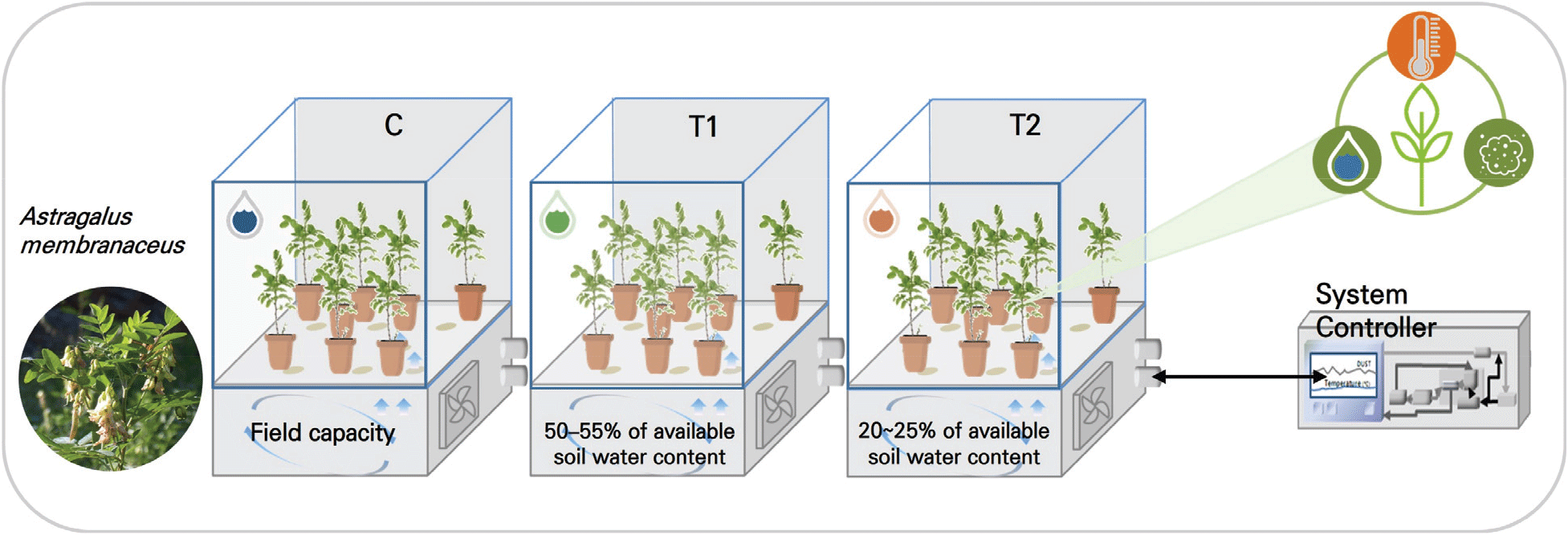
생장 특성 조사는 생체중, 건물중, 수분함량을 중심으로 이루어졌다. 실험은 건조 처리 8주 후, 각 처리구에서 3개체를 선발하여 진행하였다. 수확한 샘플은 지상부와 지하부로 나누어 채취하였으며, 지상부 샘플은 비닐봉투에 담아 실험실로 운반한 후 종이봉투에 옮겨 보관하였다. 이후 생체중은 분석용 전자저울(PAG214C, OHAUS CORPORATION, USA)을 사용하여 측정하였으며, 건물중은 건조기(HQ-FDO260, CORETECH, South Korea)를 이용해 80°C에서 72시간 동안 건조 후 동일한 방법으로 측정하였다. 지상부와 지하부의 생체중 및 건물중을 각각 조사하여 건조 스트레스가 황기의 생장 특성에 미치는 영향을 평가하였다. 이를 통해 대조구와 비교하여 처리구 간의 차이를 분석하고, 건조 스트레스에 따른 황기의 적응 및 생장 반응을 종합적으로 해석하였다.
건조 처리에 따른 황기 잎의 기체 교환 능력을 분석하기 위해 LI-6400XT 휴대용 광합성 측정기(LI-6400XT, Li-Cor, Lincoln, NE, USA)를 사용하였다. 실험은 건조 처리 후 7주차에 진행되었으며, 기체 교환 능력 측정 시 다음과 같은 조건을 설정하였다: 광합성 광량자속 밀도(Photosynthetic Photon Flux Density, PPFD)는 1500μmol m−2 s−1로 유지하였고, 챔버 내부 조건은 온도 27°C, 상대습도 50~60%, CO2 농도는 400μmol mol−1로 설정하였다. CO2 농도는 CO2 인젝터 시스템을 이용하여 안정적으로 유지하였다.
기체 교환 능력 측정은 처리구별로 각 5개체를 선발하여 맑은 날 오전에 진행하였다. 각 개체의 완전히 전개된 잎을 무작위로 선정하여 광합성률(Pn), 기공전도도(gs), 증산율(Tr)을 측정하였다. 또한, 광합성률(Pn)을 증산율(Tr)로 나눈 값을 수분이용효율(Water Use Efficiency, WUE)로 산출하여 건조 스트레스가 잎의 생리적 반응에 미치는 영향을 분석하였다.
황기 잎의 미세형태학적 특징은 주사전자현미경(Field Emission Scanning Electron Microscopy, FESEM; SU8010, Hitachi High-Tech, Tokyo, Japan)을 사용하여 관찰하였다. 시료 준비를 위해, 처리구별로 완전히 전개된 5~10개의 잎을 채취하여 페트리디쉬에 담고 아이스박스에 넣어 실험실로 운반하였다. 실험실에 도착한 후, 잎 5개를 엽면적 측정용 보드에 올려놓고 이미지를 촬영하였으며, 촬영된 이미지는 WinFOLIA PRO 2013 소프트웨어(WinFOLIA, Regent Instruments, Québec, QC, Canada)를 이용하여 엽면적을 계산하였다(Kwak et al., 2024).
엽면적 측정 후, 잎 표면의 미세구조 관찰을 위한 시료 전처리를 진행하였다. 잎의 앞면(adaxial)과 뒷면(abaxial) 표면에서 주맥을 포함한 5mm×20mm 크기의 단편을 3개씩 절단한 후, 전도성 양면 탄소 테이프가 부착된 전자현미경용 스터브(stub)에 부착하였다. 이후, 잎 표면의 형태학적 특징을 보존하기 위해 동결건조기(FD-8508, Ilshinbiobase Co., Ltd., Korea)를 사용하여 24시간 동안 수분을 제거하였다. 동결건조가 완료된 스터브는 주사전자현미경 관찰 시점까지 온도와 습도가 조절되는 데시케이터 챔버에 보관하였다.
전자현미경 촬영을 위해 이온 스퍼터 코터(Ion Sputter Coater; MC1000, Hitachi, Japan)를 사용하여 백금(platinum)으로 코팅한 뒤, 잎의 앞면과 뒷면 표면에서 기공, 트라이콤, 거칠기 등의 미세구조를 세 가지 배율(×60, ×300, ×2000)에서 관찰하였다. 이후, 주사전자현미경 관찰이 완료된 시료를 대상으로 3D 표면 분석용 광학현미경(Bruker, Contour GT-K)을 이용하여 잎 표면의 거칠기(roughness)를 측정하였으며, 건조 처리군 간의 차이를 분석하였다.
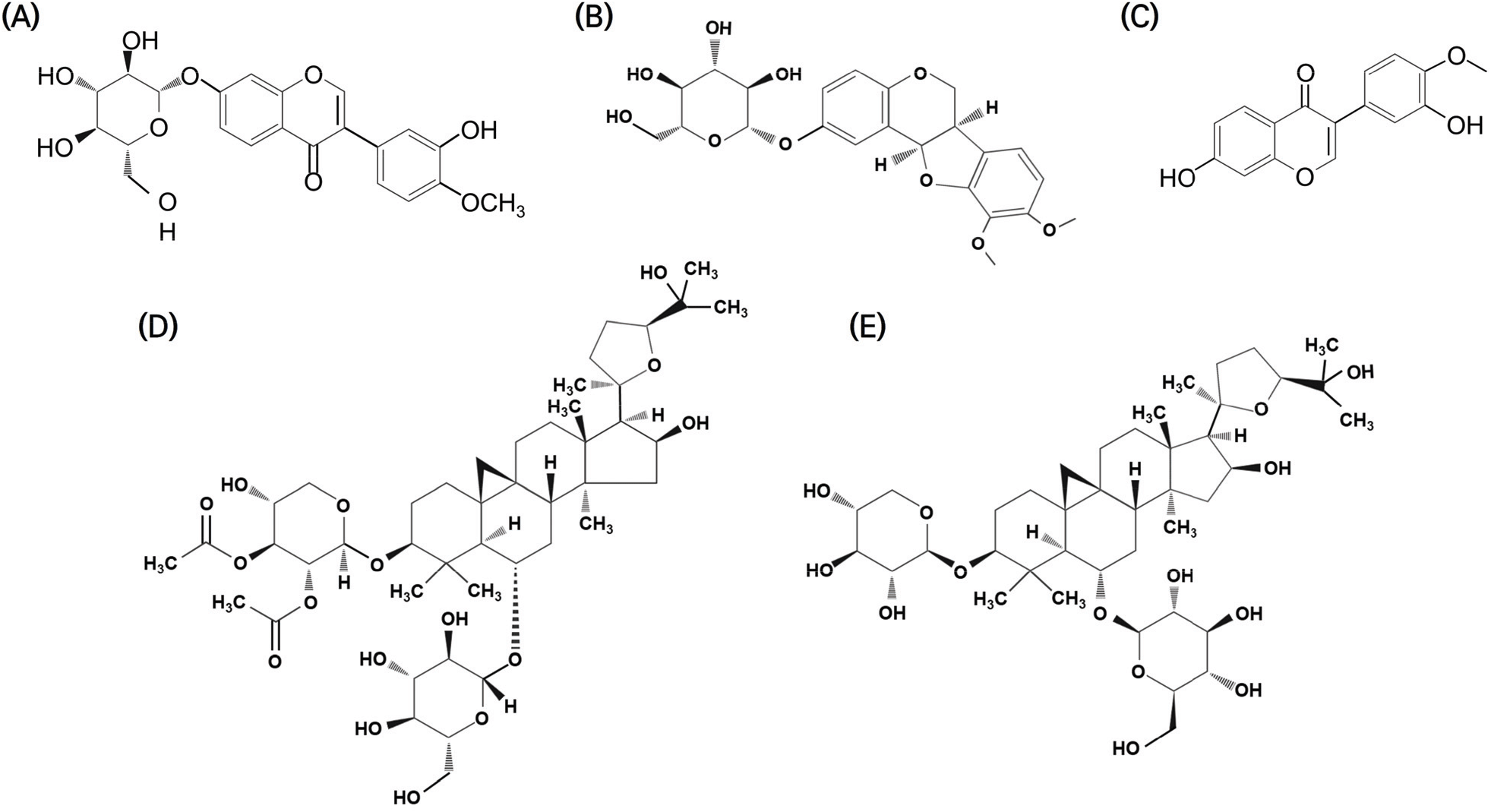
본 연구에서는 천연물로부터 고순도의 지표 물질을 분리하고 정제할 수 있는 기술을 보유한 천연물과학기술연구소에서 황기의 뿌리(Astragali radix)에 존재하는 주요 지표성분을 분석하였다. 황기의 뿌리는 온도 처리 후 무게를 측정하고, 100% 에탄올을 20배 부피로 사용하여 세 차례 환류 냉각 추출을 실시하였다. 이후 각 처리구의 뿌리 추출물 60mg을 100% 메탄올에 녹여 15mg/mL 용액(15,000 ppm)을 준비하였다. 황기의 약리적인 성분분석을 위한 표준물질로는 methylnissolin-3-O-β-d-glucopyranoside(CAS NO. 94367-42-7), calycosin-7-O-glucoside(CAS NO. 20633-67-4)을 각각 1 mg 정확히 계량하여 순수 메탄올에 녹여 0.25 mg/mL 표준용액(250ppm)을 준비하였다. 또한, calycosin (CAS NO. 20575-57-9), astragaloside I(CAS NO. 84680-75-1), astragaloside IV(CAS NO. 84687-43-4)는 각각 1mg을 정확히 계량하여 순수 메탄올에 녹여 0.5mg/mL 표준용액(500 ppm)을 준비하였다(Figure 2). 이후 표준용액들은 100% 메탄올로 희석하여 사용하였다. 뿌리 시료는 Waters e2695 Alliance HPLC 시스템(Waters, Milford, MA, USA)과 증발광산란검출기(HPLC-ELSD)를 이용하여 35°C에서 추출하였다. 분석은 YMC Pack-Pro C18 컬럼(4.6mm×250mm, 5μm, Agilent, CA, United States)에서 수행되었으며, 시료의 주입량은 10 µl였다. 이동상으로는 용매 A(0.1% 포름산을 포함한 물)와 용매 B(아세토나이트릴)를 혼합하여 사용하였다(Kwak et al., 2024).
결과 및 고찰
건조 스트레스는 황기의 생리적 및 생화학적 특성에 현저한 영향을 미쳤다. 본 연구에서 건조 스트레스가 황기의 광합성률에 미치는 영향을 분석한 결과, 시간이 지남에 따라 건조 스트레스의 강도에 따른 광합성률 차이가 명확히 드러났다(Figure 3). 1차 시기에서는 대조구(C), 중간 건조 처리구(T1), 고강도 건조 처리구(T2) 간에 광합성률의 유의한 차이가 관찰되지 않았다. 이는 초기 단계에서 건조 스트레스가 광합성에 큰 영향을 미치지 않았음을 나타낸다.
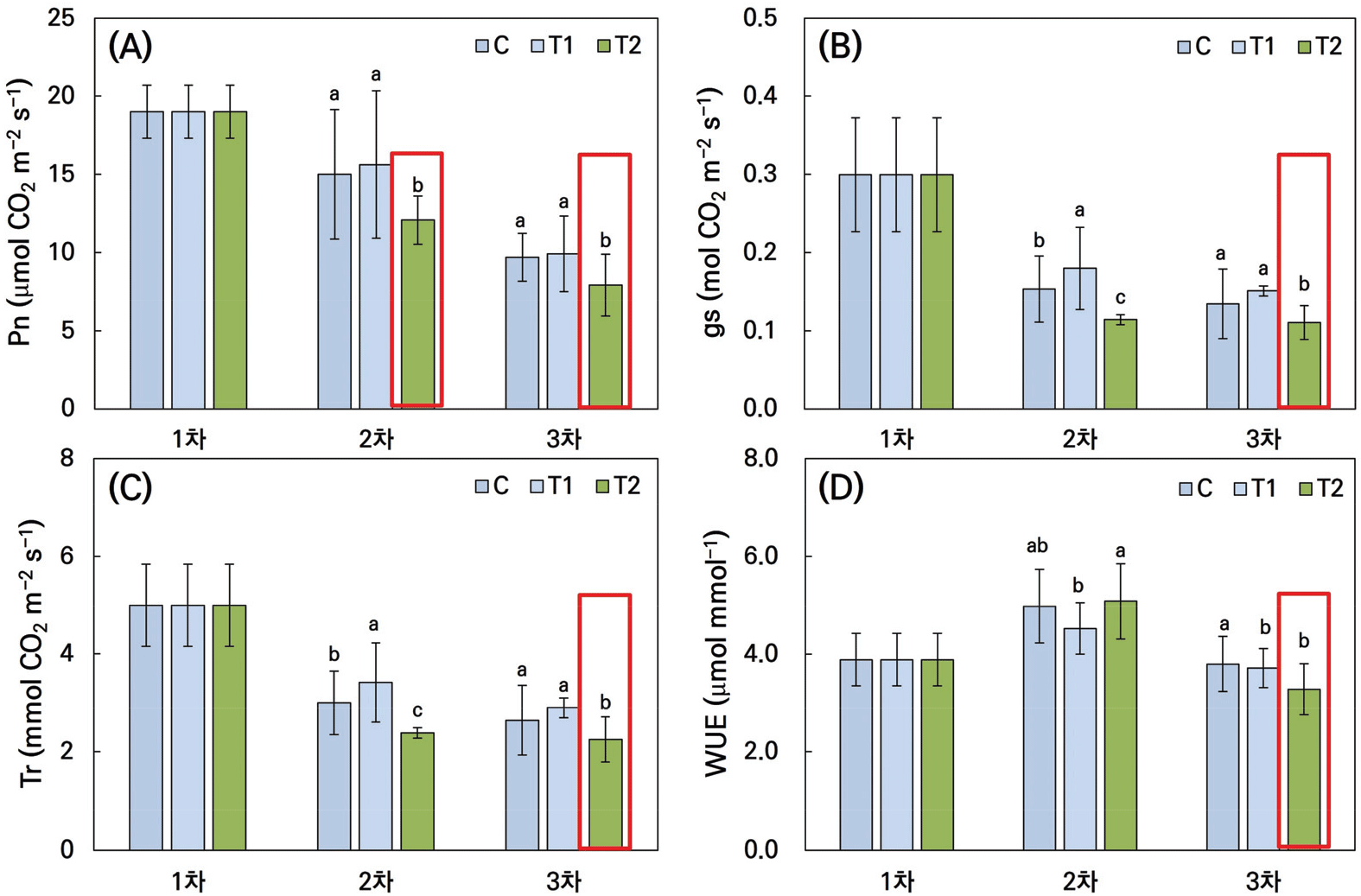
그러나 2차 시기부터 T2 처리구(토양유효수분함량 20~25%)에서 광합성률이 급격히 감소하는 양상을 보였으며, 대조구 및 T1 처리구와 비교하여 통계적으로 유의미한 차이를 나타냈다. 이러한 경향은 3차 시기에서도 유지되었으며, T2 처리구의 광합성률이 계속해서 낮은 수치를 기록하여, 고강도 건조 스트레스가 황기의 광합성에 부정적인 영향을 지속적으로 미치고 있음을 보여주었다.
이경준(2021)의 수목생리학 저서에 따르면, 수분 스트레스는 식물이 토양에서 흡수하는 양보다 더 많은 수분을 증산작용으로 잃어버리면서 체내 수분 함량이 감소하고, 그 결과 생장이 둔화된다고 한다. 건조 스트레스에 의해 세포가 팽압을 잃고 기공이 닫히며 광합성이 중단되면, 탄수화물 대사와 질소 대사가 비정상적으로 진행되며, 생장 저하를 유발한다(Hsiao and Bradford, 1983; Lee, 2017). 이러한 생리적 변화는 본 연구의 결과에서도 잘 드러났다. T2 처리구에서 관찰된 급격한 광합성률 감소는 기공 폐쇄 및 광합성 억제로 인해 식물의 에너지 생산이 저하되었음을 의미한다.
이러한 결과는 전분이 당류로 가수분해되고, 단백질 합성이 감소하는 대신 프롤린과 같은 아미노산이 축적되는 현상으로 이어질 수 있다. 특히, 황기가 고강도 건조 스트레스에 노출될 경우 광합성률이 뚜렷하게 감소하여 생리적 스트레스를 겪게 됨을 나타낸다. 시간이 지남에 따라 건조 스트레스의 강도가 증가할수록 황기의 광합성 능력이 현저히 저하되는 경향이 확인되었으며, 이는 건조 환경이 광합성 활동을 제한하고, 결과적으로 식물의 에너지 생산 능력을 저하시킴으로써 생장과 생산성에 부정적인 영향을 미친다는 점을 보여준다.
본 연구는 황기(Astragalus membranaceus)가 건조에 의한 토양 수분이 제한된 조건에서 겪는 생리적 변화를 조명하며, 특히 광합성률의 변화에 중점을 두고 분석하였다. 연구 결과에 따르면, 초기 단계에서는 건조 스트레스가 광합성에 미치는 영향이 미미했으나, 시간이 지남에 따라 고강도 건조 스트레스에 노출된 T2가 광합성률을 급격히 저하시킨 것으로 나타났다. 이는 건조 스트레스의 강도와 지속 시간이 식물의 광합성 능력에 미치는 영향을 직접적으로 보여준다. 광합성률의 감소는 대개 기공의 폐쇄와 관련이 있다. 기공 폐쇄는 증산을 줄여 수분 손실을 최소화하려는 식물의 적응 메커니즘이다. 그러나 동시에 CO2의 흡수를 제한하여 광합성 작용을 억제하게 된다(Zhao and Running, 2010). 이는 본 연구에서 고강도 스트레스 조건에서 관찰된 급격한 광합성률 감소와 일치한다. 더불어, 고강도 스트레스가 지속될수록 엽록체 손상, 광합성 효소의 비활성화, 그리고 광합성 전자전달 사슬의 교란 등 내부적인 대사 변화를 초래하여 에너지 생산이 더욱 제한될 수 있다(Farooq et al., 2009; Hu et al., 2023).
한편, 중간 강도의 건조 처리구(T1)는 광합성률 감소가 상대적으로 완화된 것으로 나타났으며, 이는 중간 수준의 스트레스가 식물의 일부 적응 메커니즘을 활성화시켰을 가능성을 나타낸다. 예를 들어, 건조 스트레스는 활성산소 제거 효소의 활성을 촉진하거나, 삼투 조절을 위한 탄수화물 및 아미노산의 축적을 증가시켜 광합성 기구를 보호할 수 있다(Hasanuzzaman et al., 2013; Anjum et al., 2017). 이와 같은 광합성 저하는 궁극적으로 식물의 전체적인 생장과 생산성을 저하시킨다. 연구에서 나타난 광합성률 감소는 지상부 바이오매스 감소와도 직접적으로 연결되며, 이는 식물의 에너지 생산이 제한되었음을 나타낸다. 이러한 결과는 이전 연구에서 가뭄 스트레스가 식물의 에너지 자원을 지하부로 재배분하여 지상부의 생장을 억제하는 현상과도 일치한다(Kramer and Boyer, 1995).
본 연구는 황기가 고강도 건조 스트레스 조건에서 광합성률이 현저히 감소하는 현상을 확인하였다. 이는 건조 스트레스 관리와 적절한 재배 기술 개발의 필요성을 강조하며, 중간 강도의 스트레스 관리 및 효율적인 수분 공급 전략이 황기의 생리적 적응을 지원하고 생산성을 극대화하는 데 중요한 역할을 할 수 있을 것으로 보인다. 또한, 건조 스트레스가 초래하는 유사한 생리적 반응은 다른 임산물에서도 나타나며, 예를 들어, 수리취(Synurus deltoides)는 건조 스트레스 하에서 광합성 활성 감소 및 삼투적·탄성적 적응을 나타내며, 이는 생산성 감소와 생리활성 물질 변화로 이어진다(Lee and Lee, 2017). 이러한 결과는 다양한 재배 식물에서 기후 변화와 건조 스트레스의 영향을 체계적으로 이해하고 이에 대응하기 위한 중요한 기초자료로 활용될 수 있다.
황기는 토양 수분이 제한될수록 지상부 생중량이 감소하는 경향을 보였다. 지상부 생중량의 경우, 대조구(C)가 T1 및 T2 처리구보다 유의적으로 높은 값을 보였다(Figure 4C). T1 처리구(50~55% 토양유효수분함량)는 대조구보다 약 16% 감소한 약 50g/plant를 기록했으며, T2 처리구(20–25% 토양유효수분함량)는 대조구와 비교하여 약 31% 감소하여 40g/plant로 가장 낮게 나타났다.
대조구는 T2 처리구에 비해 지상부 건중량이 유의미하게 높은 값을 보였다. 대조구와 비교했을 때 T1 처리구의 건중량은 약 11% 감소하였으나, 통계적으로 유의미한 차이를 보이지 않았다. 반면, T2 처리구에서는 대조구 대비 지상부 건중량이 약 26% 감소하였으며, 이는 통계적으로 유의미한 차이로 나타났다(p < 0.05). 또한, 황기의 지상부 상대수분함량(relative water content, RWC)은 건조 스트레스가 심화될수록 낮은 값을 보였다. 이는 토양 수분의 제한이 황기의 지상부 건중량과 RWC에 중요한 영향을 미친다는 가능성을 시사한다. 비록 본 연구에서 데이터를 제시하지 않았으나, 최대값에 대한 잎의 수화 수준을 나타내는 RWC는 건조 스트레스가 심화될수록 감소하는 경향이 관 찰되었다. 특히, 수분이 제한된 조건에서는 RWC와 비엽면적(specific leaf area, SLA) 사이에 상당한 역상관이 있다는 점이 제안되어 왔다. 이는 낮은 SLA를 갖는 식물 유형이 건조에 강하며, 더 높은 RWC를 유지함으로써 총 건중량 생산에서 우수한 성과를 보인다는 기존 연구 결과와도 일치한다(Nautiyal et al., 2002).
지하부 생중량의 경우, 대조구와 T1, T2 처리구 간의 차이가 상대적으로 적었으며, 통계적으로 유의미하지 않았다[Figure 4(D)]. 지하부 건중량도 지상부 건중량과 마찬가지로 대조구와 T1, T2 처리구 간의 유의미한 차이는 관찰되지 않았다.
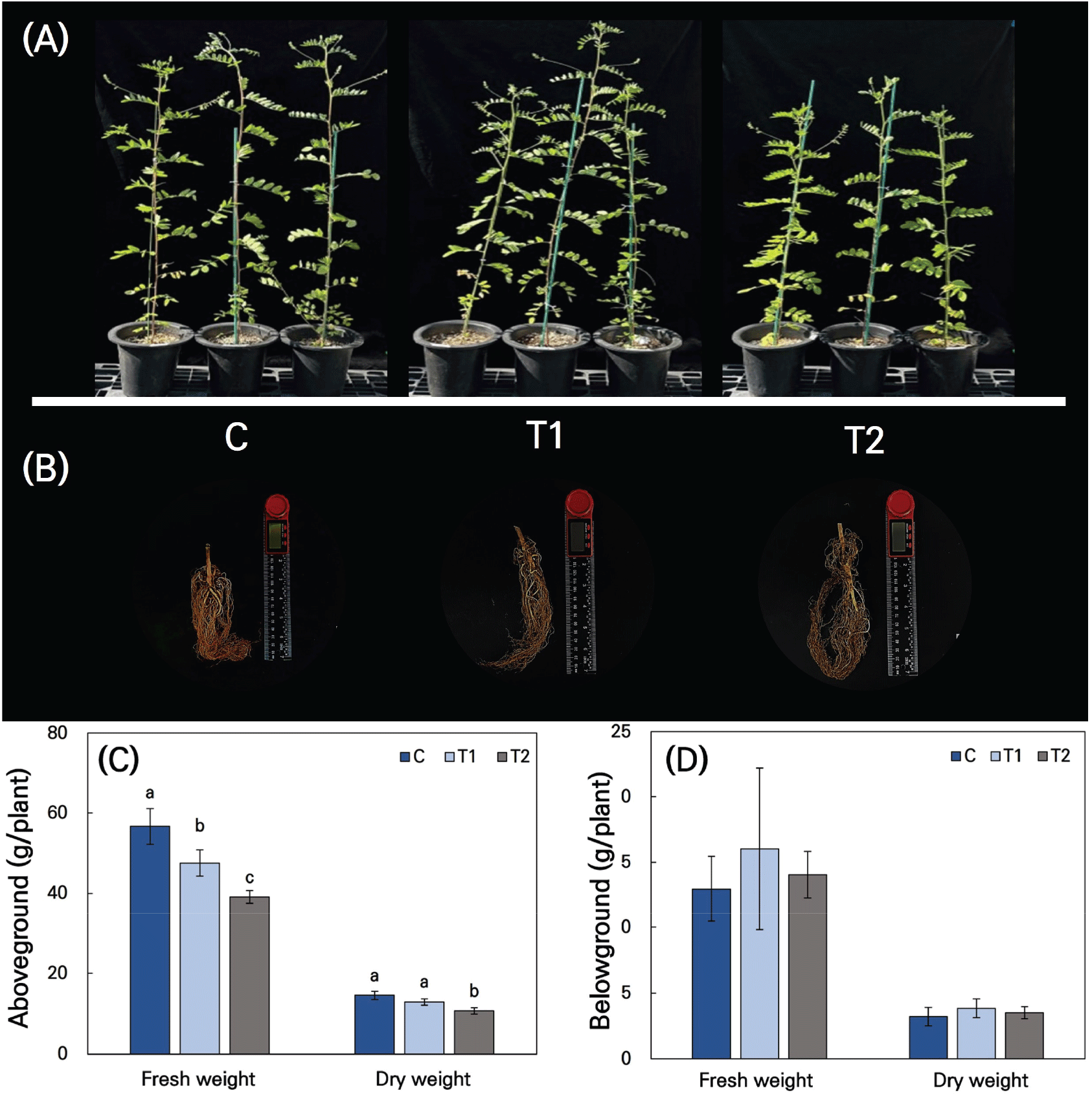
이와 같은 결과는 건조 스트레스가 초본 식물의 지상부 생장에 큰 영향을 미쳤으며, 특히 토양 수분이 극심하게 제한된 조건(T2)에서는 지상부 바이오매스가 현저히 감소하였음을 보여주었다. 반면, 초본 식물의 지하부 바이오매스는 건조 스트레스에 상대적으로 안정적인 반응을 나타냈다. 이는 초본 식물이 건조 스트레스 환경에서 생존하기 위해 지상부 생장을 억제하고 지하부로 자원을 우선적으로 분배하는 전략을 채택했음을 나타냈다(Wang et al., 2023).
그러나 본 실험은 건조 처리 8주 후의 반응을 측정한 것으로, 뿌리의 장기적인 적응 과정을 충분히 관찰하기에는 한계가 있을 수 있다. 일반적으로 초본식물의 뿌리는 수분 스트레스에 비교적 빠르게 반응하며, 재관수 시 투수성을 신속히 회복할 수 있는 특성을 가진다(Cuneo et al., 2018; Bourbia et al., 2021). 이는 초본 식물이 목본 식물에 비해 더 짧은 시간 안에 가뭄 후 수분 공급 효율성을 회복할 수 있음을 시사한다. 이러한 특성은 초본 식물이 극심한 건조 스트레스 조건에서도 빠르게 적응하고 생장을 재개하는 데 유리한 요소로 작용한다. 또한, 뿌리 수리전도도의 감소는 토양 수분 결핍 하에서 전체 식물 수력 수송 능력에 영향을 미쳐 기공 폐쇄를 유발할 수 있으며, 이는 광합성과 생장 감소로 이어질 수 있다(Rodríguez-Domínguez and Brodribb, 2019; Bourbia et al., 2021). 그러나 초본 식물은 가뭄 조건에서 더 높은 뿌리-싹 비율을 유지함으로써 상대적으로 안정적인 물 공급을 가능하게 하고, 광합성 감소를 최소화하는 적응 전략을 보여준다.
이러한 결과는 건조 스트레스가 식물의 지상부 생장을 억제하고, 제한된 자원을 효율적으로 배분하는 데 영향을 미친다는 기존 연구와 일치한다(Farooq et al., 2009; Seleiman et al., 2021; Zia et al., 2021; Kwak et al., 2024). 본 연구의 결과는 건조 스트레스가 황기의 생장과 생리적 특성에 미치는 영향을 잘 보여주며, 지상부의 생장이 지하부에 비해 건조 조건에 더욱 민감하게 반응함을 나타낸다(Shan et al., 2015; Eziz et al., 2017; Yan et al., 2023).
반면, 지하부 생중량과 건중량은 대조구와 T1, T2 처리구 간에 유의미한 차이가 관찰되지 않았다. 이는 건조 스트레스 조건에서도 황기가 지하부의 생장과 바이오매스 축적을 유지하며, 제한된 자원을 지하부로 재배분하는 전략을 채택했음을 나타낸다. 건조 환경에서 뿌리의 생장이 상대적으로 유지되거나 촉진되는 것은 물과 양분 흡수를 위한 적응 메커니즘으로 알려져 있다(Shan et al., 2015).
지상부와 지하부의 이러한 차이는 황기의 생리적 특성과 밀접한 관련이 있다. 건조 스트레스 환경에서는 지상부의 에너지 소비를 줄이고 지하부로 자원을 집중시킴으로써 뿌리의 기능을 강화하여 수분 흡수를 최대화하려는 전략이 나타난다(Gupta et al., 2020; Salvi et al., 2021; Lynch et al., 2022). 이러한 반응은 건조 조건에서 식물 생존을 위한 중요한 적응 전략이다. 본 연구의 결과는 황기가 건조 스트레스에 대처하기 위해 지상부 생장을 억제하고 지하부로 자원을 재배분하여 수분이용효율을 높이는 적응 전략을 보여준다. 이는 건조 조건에서의 생리적 조정 메커니즘으로, 생존을 위한 필수적인 반응으로 해석될 수 있다. 특히, 지상부 바이오매스의 현저한 감소와 지하부 바이오매스의 상대적 안정성은 건조 환경에 적응하기 위한 구조적 및 생리적 전략으로 알려져 있다(Kramer and Boyer, 1995; Eziz et al., 2017).
잎의 해부학적 분석에서는 건조 처리구의 황기에서 트라이콤 밀도의 뚜렷한 증가, 세포 응축, 그리고 기공 닫힘 현상이 관찰되었다(Table 1과 Figure 5). Table 1은 8주 동안 서로 다른 수분 조건(C, T1, T2)에 노출된 황기(Astragalus membranaceus) 잎의 트라이콤 밀도, 기공 크기, 그리고 기공 밀도의 변화를 비교하여 보여준다.
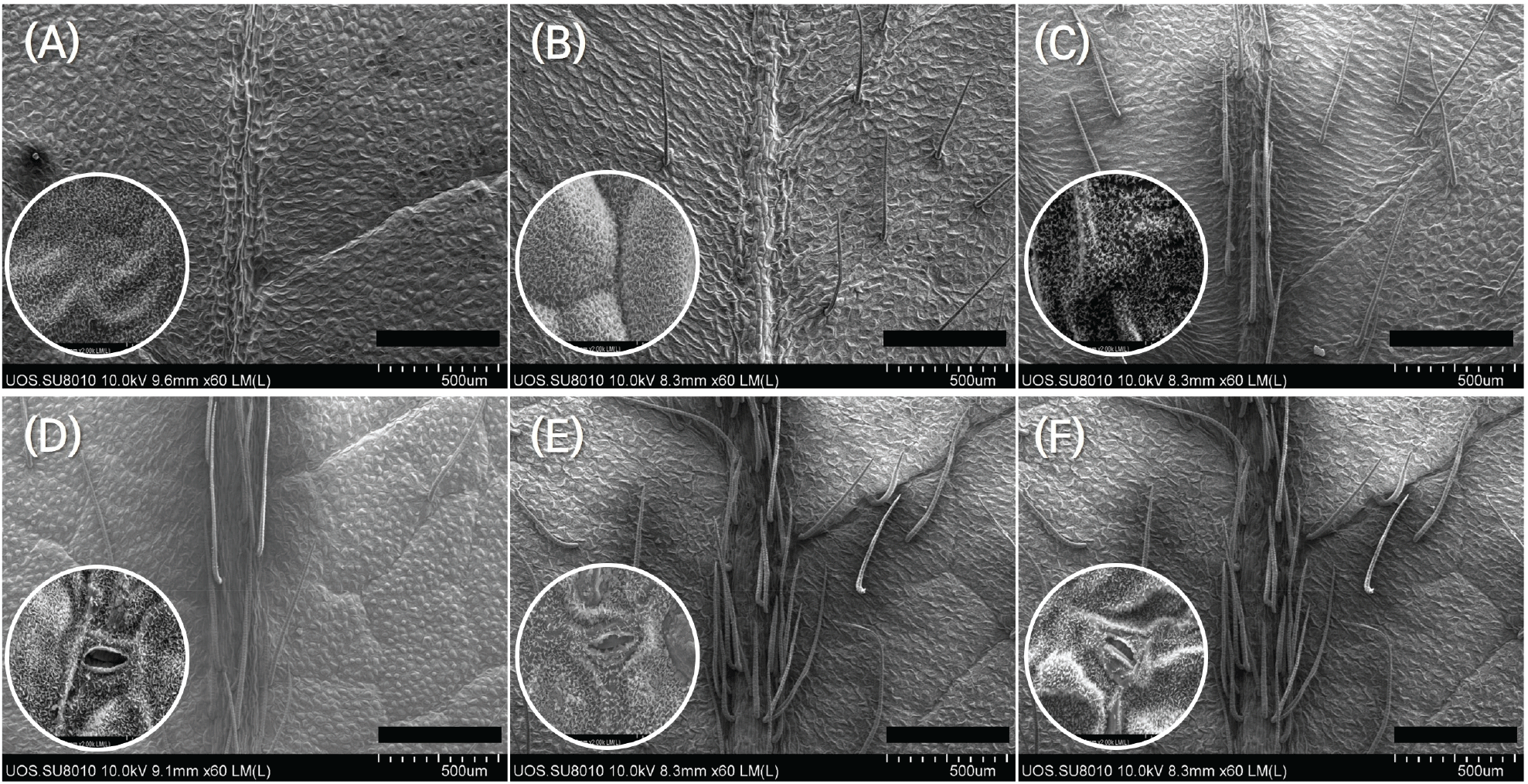
Data were analyzed using Tukey’s HSD test. Values are expressed as mean ± SD (n = 8 for trichomes and n = 20 for stomata). Means sharing the same letters are not significantly different (p < 0.05). Note: C represents field capacity; T1 represents 50~55% of available soil water content; and T2 represents 20~25% of available soil water content.
황기의 잎에서 관찰된 트라이콤 밀도는 건조 스트레스에 반응하여 증가하는 경향을 보였다. 트라이콤 밀도는 T1(토양유효수분함량 50~55%, 36.7±6.0/mm2)과 T2(토양유효수분함량 20~25%, 39.3±16.9/mm2)에서 대조구(포장용수량, 15.4±8.2/mm2)와 비교하여 통계적으로 유의미하게 높게 나타났다. 특히, T2는 가장 뚜렷한 트라이콤 밀도의 증가를 보여 건조 스트레스가 트라이콤 증가를 크게 촉진하는 요인임을 보여주었다.
토양 수분 함량이 기공 크기에 유의미한 영향을 미치는 것으로 나타났으며, T2(토양 유효수분함량 20–25%) 처리구에서 평균 기공 크기가 가장 작은 것으로 나타났다. T2는 대조구(C, 포장용수량)와 T1(토양 유효수분함량 50~55%)보다 기공 크기가 유의미하게 감소한 것으로 확인되었다. 반면, 대조구와 T1 간에는 통계적으로 유의미한 차이가 관찰되지 않았다. 이러한 결과는 토양 수분의 제한이 기공 크기를 감소시키는 주요 요인임을 나타내며, 이는 식물이 극심한 건조 조건에서 증산을 줄이고 수분 손실을 최소화하기 위한 적응 기작으로 해석될 수 있다.
기공 크기는 수분 스트레스 강도가 증가할수록 유의미하게 감소하였다. T2는 가장 작은 기공 크기(3.5±0.8μm)를 보였으며, 그다음 T1(4.5±1.1μm)과 대조구(C)(5.1±1.6μm) 순으로 나타났다. 이와 더불어, 기공 밀도는 수분 스트레스가 증가함에 따라 유의미하게 감소하였다. 대조구(C)는 가장 높은 기공 밀도(301.9±59.5/mm2)를 나타냈으며, T1 (252.0±47.3/mm2)과 T2(234.6±42.2/mm2)가 순차적으로 낮은 값을 보였다.
트라이콤은 식물의 잎과 줄기 표면에서 발견되는 구조로, 환경 스트레스에 대한 적응과 방어에서 중요한 역할을 한다. 트라이콤의 주요 기능으로는 (i) 자외선(UV) 손상 방지, 물 흡수 및 수분 손실 최소화를 포함한 비생물적 스트레스에 대한 보호, (ii) 초식동물 및 병원체에 대한 물리적 방어와 독성 또는 기피 화학물질의 분비를 통한 생물적 스트레스에 대한 보호, (iii) 특화된 대사물질의 합성과 휘발성 유기화합물 방출을 통한 식물 간 상호작용, 그리고 (iv) 꽃의 구조 조절 및 수분 매개에 도움을 주는 발달적 역할 등이 있다. 이러한 기능들은 다양한 연구를 통해 밝혀졌으며, 건조 스트레스와 같은 환경 변화에 대해 식물이 적응하는 데 있어 트라이콤의 역할이 점점 더 중요하게 여겨지고 있다(Li et al., 2023).
황기의 잎에서 관찰된 트라이콤 밀도는 토양 수분의 제한이 증가할수록 증가하는 경향을 보였다. T2 처리구에서 가장 높은 트라이콤 밀도가 관찰되었으며, 그 뒤를 T1과 대조구(C)가 뒤따랐다. 트라이콤 밀도는 처리 조건에 따라 유의미한 차이를 나타냈으며(p < 0.05), Tukey의 HSD 검정을 통해 T1과 T2가 대조구에 비해 유의미하게 높은 트라이콤 밀도를 보이는 것으로 나타났다. 특히, T2는 가장 뚜렷한 증가를 보여 건조 스트레스가 트라이콤 생산을 크게 촉진하는 요인임을 보여주었다. 이러한 결과는 트라이콤 밀도의 증가는 건조 스트레스 조건에서 수분 손실을 최소화하고 잎 조직을 보호하기 위한 적응적 형태적 변화임을 나타낸다.
이러한 형태학적 변화는 건조 환경에서 수분 손실을 최소화하고, 극한 조건에 적응하기 위한 구조적 대응으로 해석된다(Kosma et al., 2009; Farooq et al., 2012; Yang et al., 2021). 이를 종합해 보면, 건조 스트레스는 황기의 생리적, 생화학적, 그리고 구조적 변화를 통해 수분 보존과 생존을 위한 적응 전략을 유도하는 주요 요인으로 작용하였다(Ashraf et al., 2007; Hasanuzzaman et al., 2013).
건조 스트레스는 식물의 생장, 발달, 생산성에 심각한 영향을 미칠 수 있는 주요 환경적 요인이다(Farooq et al., 2009; Zhao and Running, 2000). 광합성 감소, 양분 흡수 변화, 세포 성장 저해는 식물의 기형적 생장, 시들음, 황화 현상으로 이어질 수 있으며, 궁극적으로 식물의 고사를 초래할 수 있다(Fischer et al., 2002; Zhao and Running, 2000; Kwak et al., 2024). 이러한 건조 스트레스의 영향은 식물의 종, 발달 단계, 건조의 기간 및 강도에 따라 상이하게 나타날 수 있다(Anjum et al., 2017; Riedesel et al., 2023; Sun et al., 2024).
식물은 모든 생명체와 마찬가지로 광합성, 양분 수송, 세포 성장과 같은 다양한 생리적 과정에 있어 수분을 필수적으로 요구한다(Ashraf et al., 2007; Farooq et al., 2009). 토양 수분이 감소하면 식물은 건조 스트레스를 경험하게 되며, 이는 가스 교환 능력을 포함한 전반적인 생리적 과정에 상당한 영향을 미친다. 특히, 광합성 능력 저하와 함께 기공전도도 및 증산속도의 변화는 식물의 생리적 균형을 깨뜨려 생산성을 저하시킨다(Fischer et al., 2002) (Table 2).
Data were analyzed using Tukey’s HSD test. Values are expressed as mean ± SD of 5 replicates. Means sharing the same letters are not significantly different (p < 0.05). ND indicates “Not Detected.” Treatments are defined as follows: C represents field capacity; T1 corresponds to 50~55% of available soil water content; and T2 denotes 20~25% of available soil water content.
건조 스트레스 처리에 따른 황기 뿌리(Astragali radix)에서 주요 생리활성 지표성분으로 astragaloside I, calycosin, methylnissolin-3-O-β-d-glucopyranoside, calycosin-7-O-glucoside, astragaloside IV가 검출되었으며, 이는 아래 표에 명시된 바와 같이 명확히 식별되었다(Table 1). 이러한 지표성분들은 황기의 약리학적 가치와 생리적 특성을 이해하는 데 중요한 기준으로 작용한다.
특히, 황기 뿌리의 주요 지표성분 중 하나인 calycosin-7-O-glucoside는 건조 스트레스 처리 강도가 심화될수록 대조구(C)와 비교하여 유의미하게 높은 함량을 나타냈다(p < 0.05). 이는 건조 스트레스가 해당 성분의 생합성을 촉진하거나 대사 경로에 영향을 미쳤을 가능성을 시사한다. 반면, astragaloside I과 astragaloside IV는 높은 건조 처리 강도(T2)에서 대조구에 비해 유의미하게 낮은 함량을 보였다(p < 0.05). 이러한 경향은 이전 연구에서 온도구배 하우스 내 대기 온도 상승 처리 결과와 유사한 것으로 나타났다.
이 결과는 건조 스트레스가 황기 뿌리의 주요 생리활성 성분에 차별적인 영향을 미쳐, 특정 지표성분의 축적 또는 감소를 유발함으로써 황기의 약리학적 특성과 생화학적 반응이 조절될 수 있음을 시사한다.
본 연구에서 건조 스트레스가 황기의 약리학적 성분에 미친 영향은 화합물별로 다르게 나타났다. 예를 들어, calycosin-7-O-glucoside의 함량은 건조 스트레스 강도가 높아질수록 유의미하게 증가하였으며, 이는 스트레스 조건에서 특정 대사 경로가 활성화되었음을 시사한다. 반면, astragaloside I과 astragaloside IV는 높은 건조 스트레스 강도에서 함량이 감소하였으며, 이는 건조 스트레스가 일부 2차 대사물의 축적을 억제하거나, 대사 전환 과정에서 다른 화합물로 전환되었을 가능성을 제시한다(Yadav et al., 2021; Shil et al., 2022).
이러한 결과는 건조 스트레스가 황기의 약리학적 특성에 다양한 방식으로 영향을 미친다는 점을 명확히 보여준다. 건조 스트레스는 식물의 생리적 상태를 변화시키며, 특정 화합물의 합성 및 축적을 조절하여 약리학적 성분의 조성과 농도를 변화시킨다(Anjum et al., 2011; Kwak et al., 2024).
본 연구의 결과는 황기가 건조 스트레스 환경에서 적응하기 위해 다양한 생리적, 형태적, 약리학적 전략을 활용함을 시사한다. 이러한 연구는 기후변화에 대응한 지속 가능한 생산체계 구축과 황기의 약리학적 가치 극대화를 위한 기초자료로 활용될 수 있다. 향후 연구에서는 황기의 유전자 발현 및 대사 경로 분석을 통해 건조 내성 메커니즘을 보다 심층적으로 규명하는 것이 필요하다.
결 론
본 연구는 토양의 수분 제한이 황기의 생리적, 형태적, 약리학적 특성에 미치는 영향을 종합적으로 분석하였다. 건조 스트레스는 광합성률과 지상부 바이오매스를 감소시키며, 잎의 트라이콤 밀도 증가와 기공 크기 감소를 통해 수분 손실을 최소화하는 적응 메커니즘을 보여주었다. 약리학적 성분 분석 결과, 건조 스트레스는 calycosin-7-O-glucoside의 축적을 촉진하였으나 astragaloside I과 IV의 함량은 감소시켰다.
이러한 결과는 건조 스트레스가 황기의 생리적 반응와 대사 과정을 조절하여 생존 및 적응에 관여하는 주요 환경적 요인으로 작용함을 보여준다. 특히, calycosin-7-O-glucoside는 항산화, 항염증 및 면역 조절과 같은 다양한 약리적 효과를 가지며, 함량 증가를 통해 황기의 약리학적 활용 가능성을 높일 수 있음을 나타낸다. 반면, astragaloside I과 IV는 면역 강화 및 항암 효과로 잘 알려진 물질로, 이들 함량의 감소는 재배 환경을 조정함으로써 보완될 가능성을 제기한다. 따라서, 재배 조건의 최적화를 통해 황기의 약리학적 성분을 조절하고 강화할 수 있는 가능성을 탐구할 필요성을 강조한다.
향후 연구에서는 황기의 건조 내성 메커니즘을 보다 심층적으로 이해하기 위해 유전자 발현, 단백질 상호작용, 대사 경로 분석과 같은 다각적 접근이 필요하다. 이러한 연구는 황기의 약리학적 가치와 건조 내성을 극대화하는 품종 개발 및 재배 전략 수립에 기여할 것이다. 또한, 본 연구의 결과는 건조 스트레스 환경에서도 안정적인 생산성을 유지할 수 있는 작물의 재배 적지 선정 및 관리를 위한 실용적 지침을 제공할 수 있다.
