Article
아까시나무의 화밀 특성 및 잠재적 꿀 생산량 평가
박지민
1, 나성준
1, 권해연
1, 김영기
2,*
Evaluation of Nectar Characteristics and Potential Honey Production of Robinia pseudoacacia
Ji-Min Park
1, Sung-Joon Na
1, Hae-Yun Kwon
1, Young-Ki Kim
2,*
1Special Forest Resources Division, National Institute of Forest Science, Suwon 16631, Korea
2Department of Forest Resources, Sunchon National University, Suncheon 57922, Korea
© Copyright 2025 Korean Society of Forest Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Feb 19, 2025; Revised: Mar 05, 2025; Accepted: Mar 06, 2025
Published Online: Mar 31, 2025
요 약
아까시나무(Robinia pseudoacacia)는 국내 주요 밀원수로 인식되지만 밀원가치를 정량적으로 평가한 연구는 전무한 실정이다. 이에 본 연구는 아까시나무의 생장, 개화, 화밀 특성을 분석하여 잠재적 꿀 생산량을 추정하고, 생태적 및 산업적 활용성을 평가하였다. 세 지역을 대상으로 다수의 조사목을 선정해 수고, 근원경, 수관폭, 개체당 꽃 수를 조사하여 생장 특성이 반영된 단위 면적 당 꽃수를 추정하였으며, 화밀분비량, 유리당 및 아미노산 함량 등 화밀 특성을 분석하였다. 그 결과, 꽃 하나당 화밀 분비량은 1.5~3.0 μL/flower, 꽃 하나당 유리당 함량은 1.5~1.8 mg/flower 범위였으며, 단위 면적당 잠재적 꿀 생산량은 22.6~37.6 kg/ha로 추정되었다. 한편, 아까시나무 화밀은 자당이 60.0% 이상으로 sucrose-dominant 등급에 해당되며, 아미노산은 총 20종이 존재하는 것으로 나타나 꿀벌을 포함한 화분매개자의 영양 요구를 충분히 지원할 수 있는 것으로 판단된다. 본 연구는 국내 자생 아까시나무의 밀원가치를 정량적으로 평가한 첫 연구라는 점에서 의미가 있으며, 밀원숲 조성 및 화분매개자 보호 전략을 수립하기 위한 기초 자료로서 활용할 수 있을 것으로 판단된다.
Abstract
Robinia pseudoacacia is recognized as a major honey tree in Korea; however, there are virtually no studies that have quantitatively evaluated its honey production value. Therefore, this study investigated the growth, flowering, and nectar characteristics of R. pseudoacacia to estimate its potential honey production value and evaluate its ecological and industrial usefulness. After selecting study plots in three regions, growth characteristics such as height, root collar diameter, crown width, and number of flowers per tree were analyzed to estimate the number of flowers per unit area. Nectar volume and sugar and amino acid contents were also analyzed. Nectar volume per flower ranged from 1.5 to 3.0 μL/flower, and the sugar content per flower ranged from 1.5 to 1.8 mg/flower. Potential honey production value was estimated at 22.6-37.6 kg/ha. Moreover, floral nectar was found to be sucrose-dominant, with >60.0% sucrose content, and contained 20 amino acids, suggesting that it can adequately support the nutritional requirements of pollinators, including honeybees. This study is significant as the first investigation to quantitatively evaluate the honey-producing value of R. pseudoacacia in Korea, and the results can be used as basic data for establishing strategies to produce honey plant complexes and protect pollinators.
Keywords: Robinia pseudoacacia; nectar characteristics; flower abundant; potential honey production
서 론
식물과 화분매개자 간의 상호작용(plant-pollinator interactions)은 양쪽 모두의 생존에 필수적이다(Ollerton et al., 2011; Garibaldi et al., 2020). 화분매개자에 의해 이루어지는 꽃가루 이동 덕분에 많은 식물의 유전 다양성이 유지되며, 화분매개자는 식물로부터 생존에 필요한 먹이자원을 공급받는다(Potts et al., 2010; Filipiak et al., 2017). 최근 국내를 비롯한 많은 국가에서 화분매개자 개체수 감소 현상이 보고되고 있는데(Rhodes, 2018; López-Uribe et al., 2020), 그 원인으로 서식지 감소, 기후변화, 농약 및 살충제 남용, 꿀벌 질병, 그리고 먹이부족 등이 지목되고 있다(Goulson et al., 2015).
꿀벌을 비롯한 다양한 화분매개자는 밀원식물에서 유래한 화밀(floral nectar)을 주요 먹이자원으로 이용함으로 밀원식물은 화분매개자의 생존과 번성에 필수적인 요소이며(Isbell et al., 2017; Sutter et al., 2017), 영양학적으로 균형 잡힌 고품질의 화밀은 화분매개자의 성장과 발달, 면역체계를 향상시킨다(Alaux et al., 2010; Sirohi et al., 2015). 따라서 화분매개자 보호를 위한 밀원식물의 선정은 수종별 먹이 공급량 및 품질에 대한 정보가 요구되며(Jachuła et al., 2018), 개화기간, 개화량, 화밀의 양과 구성 등 밀원식물에 대한 전반적인 정보가 요구된다(Ayers and Rehan, 2021; Tew et al., 2021).
밀원가치에 대한 정보는 지속가능한 꿀벌 보호를 위한 밀원숲 조성체계를 최적화하고자 하는 정책입안자들에게 도움이 될 수 있다(Baldock, 2020; Braman and Griffin, 2022). 특히, 목본식물은 수분매개자의 먹이자원을 개선하기 위해 비용적인 측면에서 효율적이고, 장기적으로 지속 가능하다는 장점이 있다(Donkersley, 2019; Bożek et al., 2023), 이는 목본식물이 초본식물보다 꽃수가 많고(Baude et al., 2016; Daniels et al., 2020), 보다 영양가 있는 화밀과 꽃가루를 제공한다는 것과 관련이 있다(Vaudo et al., 2015; Filipiak, 2019).
최근에는 다양한 수종의 화분매개자의 먹이공급이나 양봉산물 생산에 기여하는 가치를 평가하기 위해 생장 특성, 개화량, 화밀 특성을 종합적으로 고려하여 본당 또는 단위 면적당 꿀 생산량을 추정하는 연구가 활발히 이루어지고 있다(Adgaba, 2017; Cavalcante et al., 2018; Broyles and Stoj, 2019; Bareke et al., 2021). 아까시나무(R. pseudoacacia)는 국내 천연꿀 생산량의 70%를 차지하는 주요 밀원수이지만(Lee et al., 2004), 밀원가치 평가 연구는 특정 지역에 한정되었거나(Han et al., 2009), 꿀벌 유인과 관련한 향기 성분 비교 연구(Jung et al., 2017; Lee et al., 2019) 등에 그쳐 매우 미흡한 실정이다. 본 연구는 아까시나무(R. pseudoacacia)의 밀원가치를 정량적으로 평가함으로써, 국내 양봉산업의 지속 가능성을 지원하고(Han et al., 2009), 화분매개자 보호 및 생태계 복원에 기여할 수 있는 기초 자료를 제공하는 것을 목적으로 한다. 또한 아까시나무의 화밀 특성과 잠재적 꿀 생산량 분석을 통해 밀원숲 조성 및 기후 변화에 따른 밀원식물 관리 전략 수립에 활용(Adgaba et al., 2017; Baldock, 2020; Daniels et al., 2020)할 수 있는 실질적인 데이터를 제시하고자 한다.
재료 및 방법
1. 생장 및 개화량 측정
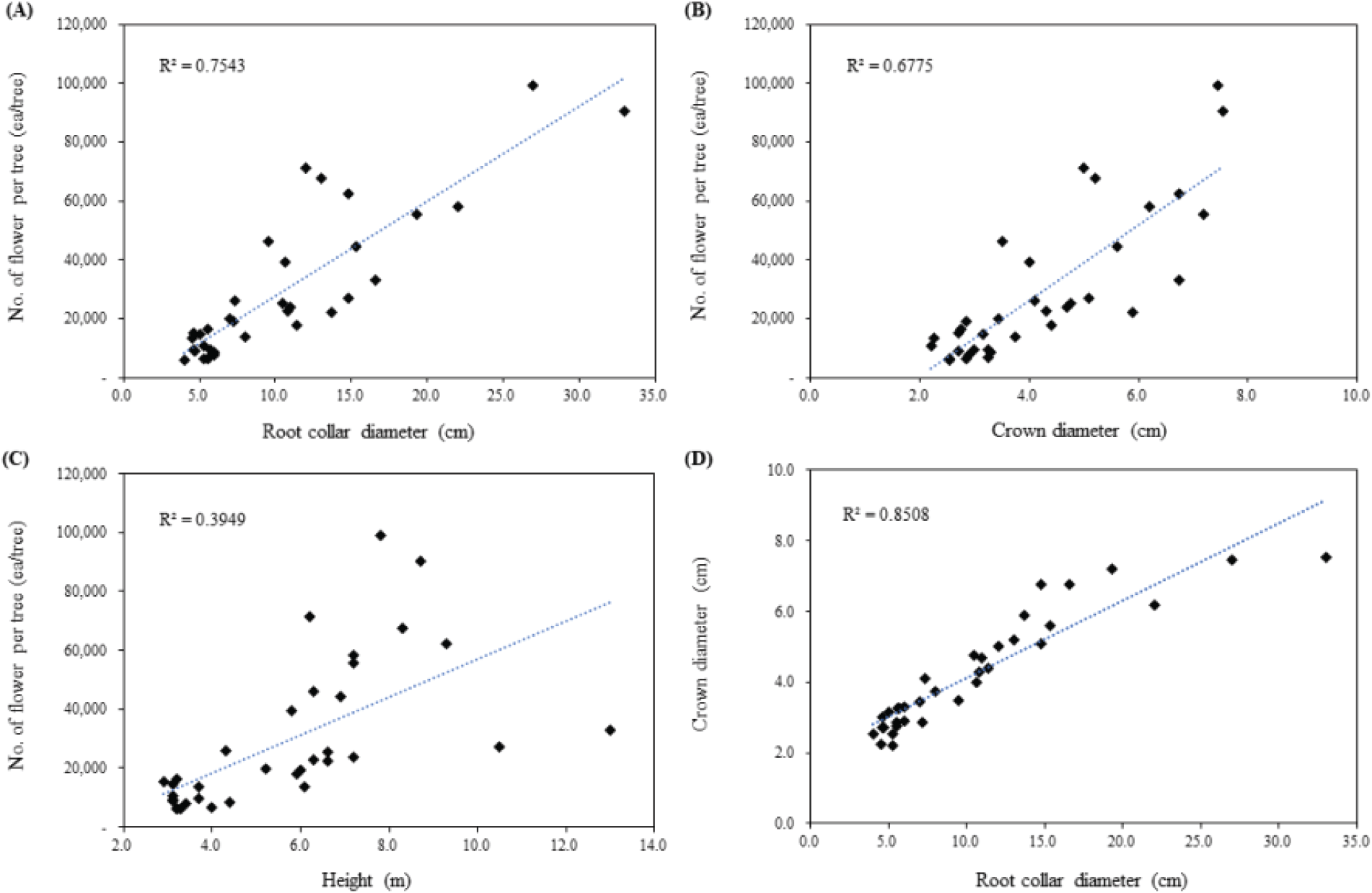
지역별 생장 및 화밀 특성을 분석하기 위해 전국을 대상으로 아까시나무 분포를 확인하였으며, 실제 이동양봉 채밀 경로에 있는 3 지역(보령, 수원, 철원)에서 전체 35본의 조사목을 수고, 근원경이 고루 분포하도록 선정하였다(Table 1). 경기 수원 지역(37°16'3"N, 126°56'49"E)에서 선정된 8본은 수고 3.4~9.3 m, 근원경 4.5~14.8 cm, 수관폭 2.3~6.8 m 범위였으며, 보령 지역(36°19'21"N, 126°38'18"E) 조사목 9본은 수고 2.9~8.3 m, 근원경 4.0~19.3 cm, 수관폭 2.2~7.2 m 범위였다. 철원 지역(38°14'39"N, 127°27'53"E)은 18 본의 조사목을 선정하였으며, 수고 5.2~13.0 m, 근원경 7.0~33.0 cm, 수관폭 2.9~7.0 m 범위이었다.
Table 1.
Height, root collar diameter, and crown diameter and flower abundant per tree of R. pseudoacacia in three regions.
|
Region |
Location |
Height (m) |
Root collar diameter (cm) |
Crown diameter (m) |
No. of flower per inflor. (ea)1
|
No. of flower per tree (ea) |
|
Suwon |
37°16'3.2"N
126°56'49"E |
5.7 (3.4-9.3) |
9.2 (4.5-14.8) |
4.1 (2.3-6.8) |
23.7±0.7 (19.2-28.6) |
32,322 (7,898-71,305) |
|
Boryeon |
36°19'21.7"N
126°38'18"E |
4.6 (2.9-8.3) |
7.8 (4.0-19.3) |
3.7 (2.2-7.2) |
23.2±0.8 (16.5-28.0) |
19,534 (6,076-67,495) |
|
Cheorwon |
38°14'39.0"N
127°27'53"E |
8.0 (5.2-13.0) |
17.1 (7.0-33.0) |
5.5 (2.9-7.6) |
25.1±0.8 (18.0-29.7) |
45,994 (19,258-99,158) |
Download Excel Table
생장 특성과 개화량 기반한 본당 및 단위 면적당 꿀 생산량을 추정하기 위해 화서 수, 화서당 꽃 수를 이용하여 본당 개화량을 산출하였다(Jachuła et al., 2019). 본당 화서 수는 전수조사하였으며, 화서당 꽃 수는 조사목마다 각 20개의 화서를 채취하여 조사하였다. 수원, 보령 및 철원 지역의 화서당 꽃수는 각각 23.7개, 23.2개 및 25.1로 지역별 차이가 없었으며, 본당 화서 수를 곱해 산출된 본당 꽃 수는 수원 지역이 7,898-71,305개, 보령 지역이 6,076-67,495개, 철원 지역이 19,258-99,158개 범위였다. 이 결과는 생장 특성에 따른 본당 및 ha당 꽃수를 추정하기 위한 회귀식을 도출하는데 이용하였다.
2. 화밀 수집
화밀 수집을 위해 정상적으로 생육하는 3 본의 조사목을 대상으로 이미 개화한 꽃은 제거한 후 화분매개자 차단망을 10개씩 설치하였다(Biella et al., 2021). 사전 관찰 결과, 아까시나무 꽃 하나는 2일간 개화하는 것을 확인하여 차단망 설치 후 다음날 개화한 꽃에 표시하는 방식으로 2일 누적 개화한 꽃만을 선별하였으며 꽃 채취는 오후 4시에 수행하였다(Broyles and Stoj, 2019). 본당 300개(차단망당 30개)의 꽃을 채집하여 원심분리기 (Microfuge 16, Beckman Coulter, USA)를 이용하여 4,000 rpm으로 4분 동안 화밀을 수집하였다(Swanson and Shuel, 1950; Armstrong and Paton, 1990). 수집된 화밀은 50-100 μL microliter syringe (Hamilton Co., Reno, NV, USA)를 사용하여 정량하였으며, 화밀 내 미생물에 의한 당 분해를 방지하기 위해 80% 에탄올(v/v)을 화밀량의 10배를 첨가했다(Power et al., 2018). 마지막으로 0.45 μM pore centrifuge filter를 이용하여 정제하여 화분 등 이물질을 제거하였으며, 이후 HPLC를 이용한 유리당 및 아미노산 분석 전까지 −20°C에서 보관하였다.
3. 유리당 및 아미노산 분석
유리당 분석은 HPLC (Dionex ultimate 3000, Dionex, USA)를 이용하여 분석하였다. 이동상으로는 3차 증류수를 사용하였고, 유속은 0.5 ml/min, 온도는 80°C로 설정하였다. 유리당의 표준품으로는 sucrose, glucose, fructose (Sigma Aldrich, USA)를 사용하였으며, Aminex 87P column (Bio-rad, USA)을 사용하여 Ri-101 detector (Shodex, Japan)로 유리당을 검출하였다. 각 유형별로 식별된 당 구성을 이용해 S/H ratio(sucrose/glucose+fructose)와 G/F ratio(glucose/fructose)를 산정하였다(Nicolson and Thornburg, 2007).
아미노산은 HPLC (1200 series, Agilent Technologies, USA)를 이용하여 분석하였다. 이동상은 10 mM Na2HPO4, 10 mM Na2B4O7·10H2O가 포함된 A용액(pH 8.2)과 Water: Acetonitrile:Methanol를 10:45:45 비율로 혼합된 B용액을 초기 100% 대 0%(v/v)에서 26~28분에 55% 대 45% 비율로, 28~30.5분에 0% 대 100% 비율로, 30.5분부터는 100% 대 0% 비율로 구배 조건을 설정하였다. 유속 1.5 mL/min에서 주입량은 0.5 μL, column 온도는 40°C로 설정하고 Inno column C18 (Innopiatech, Korea)을 사용하였다. 자외선 검출기는 338 nm로 설정하였고, 형광 검출기를 이용하여 O-phthalaldehyd(OPA) 유도체는 방출 파장 450 nm, 여기 파장 340 nm, Fluorenylmethyl chloroformate (FMOC) 유도체는 방출 파장 305 nm, 여기 파장 266 nm에서 분석하였다.
4. 잠재적 꿀 생산량 추정
꽃 하나당 화밀량과 단위용량당 당 및 아미노산 함량의 곱으로 꽃 하나당 당과 아미노산 함량을 산출하였으며, 생장 특성에 따른 개화량을 산출하여 본당 및 ha당 잠재적 꿀 생산량을 추정하였다(Kim et al., 2021a, 2021b; Kim et al., 2022).
-
꽃 하나당 유리당·아미노산 함량 = 꽃 하나당 화밀 분비량 × 단위용량당 유리당·아미노산 함량
-
본당 생산량 = 꽃 하나당 유리당·아미노산 함량 × 본당 꽃 수
-
ha당 꿀 생산량 = 본당 생산량 × ha당 생립 가능 본 수
5. 동계 분석
본 연구에서는 지역간 생장 특성, 꽃 하나당 화밀량, 당 함량(자당, 포도당, 과당) 등을 비교하기 위해 통계 소프트웨어 패키지인 JMP 18.1.1 software (SAS Institute, Cary, NC, USA)를 활용하여 일원분산분석(ANOVA), T-검정(T-test) 및 Tukey의 다중범위검정(Tukey’s Honestly Significant Difference)을 수행하였으며, 유의수준은 0.05로 설정하였다.
결 과
1. 생장 특성에 따른 꽃수 추정
생장 특성에 따른 개화량을 추정하기 위해 선형 회귀식을 도출한 결과, 본당 개화량과 가장 강한 상관을 나타낸 변수는 근원경(R2=0.7543) 이었으며, 수관폭 또한 근원경과 매우 높은 상관(R2=0.8508)을 나타냈다(Figure 1). 이에 근원경에 따른 수관폭과 본당 개화량을 산출하고, 단위면적당 생육 본수를 이용하여 본당 및 ha당 꿀 생산량을 추정하였다.
2. 화밀 분비량, 유리당 함량
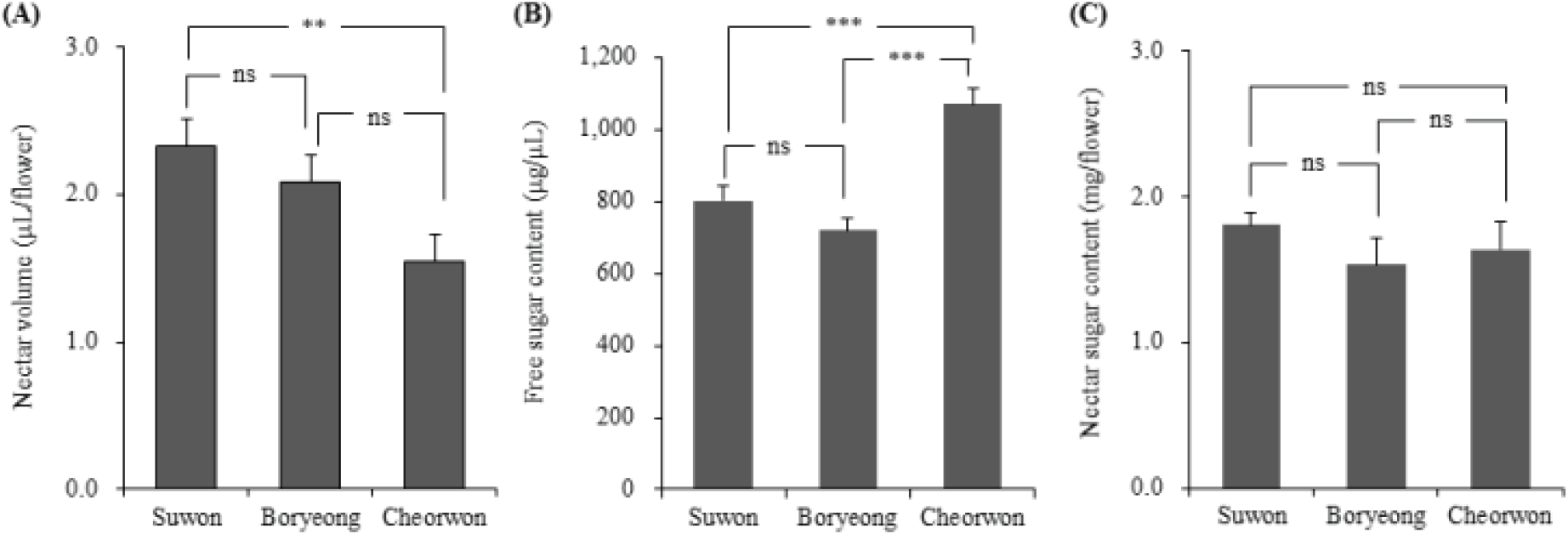
아까시나무의 개화 2일 동안의 누적 화밀 분비량, 단위 용량당 유리당 함량 및 꽃 하나당 유리당 함량은 Figure 2와 같다. 수원 지역의 꽃 하나당 화밀 분비량은 평균 2.3±0.2 μL/flower로 가장 높았으며, 다음으로 보령 지역이 2.1±0.2 μL/flower, 철원 지역이 1.5±0.5 μL/flower로 가장 낮게 나타났다. 통계적으로 수원과 철원 지역 간의 차이는 인정되었지만(p < 0.01), 수원 지역과 보령 지역 간, 보령 지역과 철원 지역 간은 유의차는 인정되지 않았다.
Figure 2.
Comparison of nectar volume (A), free sugar content (B) and nectar sugar content (C) in R. pseudoacacia across three regions (p < 0.001, ***; p < 0.01, **; p < 0.05, *; ns, non-significant).
Download Original Figure
단위 용량당 유리당 함량은 철원 지역이 평균 1,070.2± 135.1 μg/μL로 가장 높게 나타났으며, 다음으로 수원 지역은 평균 802.2±130.9 μg/μL, 보령 지역이 평균 718.6±107.2 μg/μL로 가장 낮게 나타났다. 통계적으로 철원 지역의 단위용량당 유리당 함량은 수원 지역과 보령 지역과 각각의 유의한 차이가 인정되었었으며(p < 0.05), 수원과 보령 지역간 차이는 없었다.
화밀 분비량과 단위용량당 유리당 함량의 곱으로 산출한 꽃 하나당 유리당 함량은 수원 지역이 평균 1.8±0.3 mg/flower으로 가장 높았으며, 철원 지역과 보령 지역이 각각 1.6±0.2 mg/flower과 1.5±0.6 mg/flower으로 나타났으며, 세 지역간 통계적 유의차는 나타나지 않았다. 결과적으로 화밀 분비량과 단위용량당 유리당 함량은 지역간 차이가 있음에도 이를 종합적으로 고려해 산출한 꽃 하나당 유리당 함량은 지역간 차이가 없었다.
3. 유리당 구성
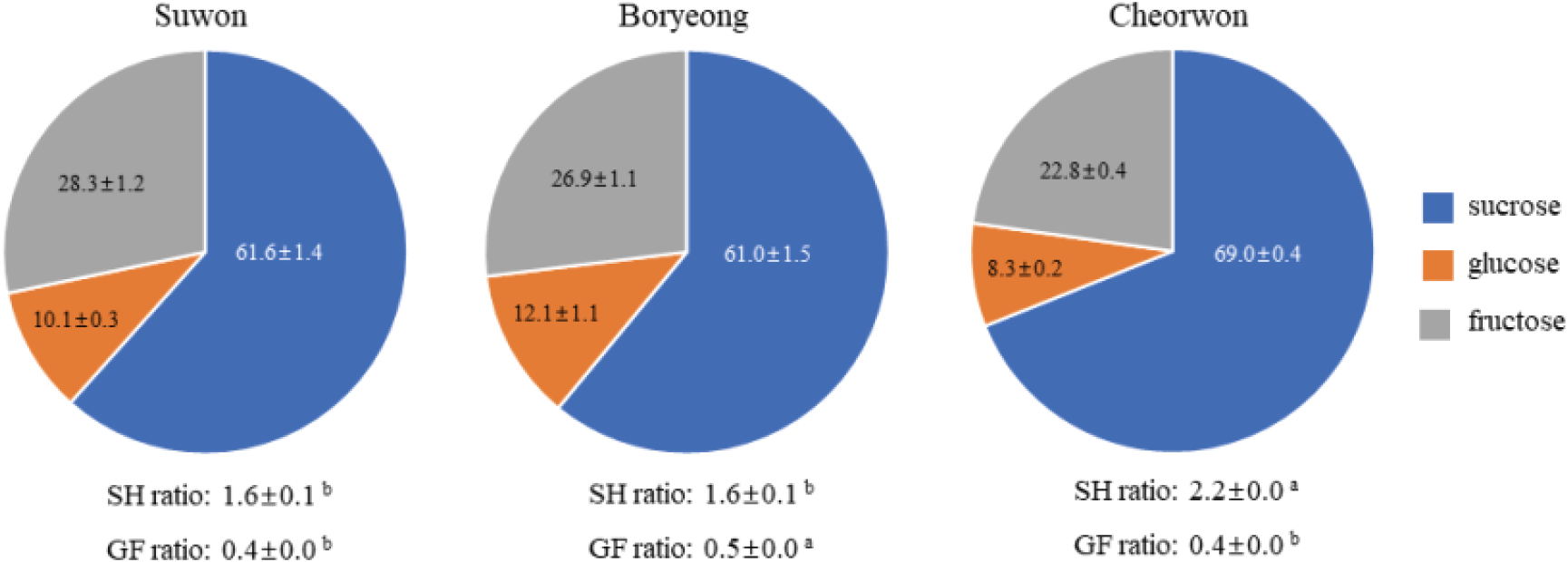
화밀 내 유리당 구성을 분석한 결과, 아까시나무의 유리당은 60% 이상의 자당(sucrose)과 약 20~30%의 과당(fructose), 그리고 10% 내외의 포도당(glucose)으로 구성된 것으로 나타났다(Figure 3). 지역별로 살펴보면, 수원 지역은 자당 61.6±4.7%, 포도당 10.1±1.1%, 과당 28.3±4.1%로 구성되어 있었으며, 보령 지역은 자당 61.0±4.5%, 포도당 12.1±3.3%, 과당 26.9±3.4%로 나타냈다. 철원 지역은 자당이 69.0±1.3%, 포도당 8.31±0.2%, 과당 22.8±0.4%로 세 지역 중 자당 대 육탄당 비(S/H ratio)가 2.2로 가장 컸다 (p < 0.05). 수원과 보령 지역의 자당 대 육탄당 비는 각각 1.6±0.1로 동일하였으며, 포도당 대 과당 비(G/F ratio)는 수원과 철원 지역이 0.4, 보령 지역이 0.5로 나타났으며 통계적으로 유의하였다 (p < 0.05).
4. 아미노산 함량 및 구성
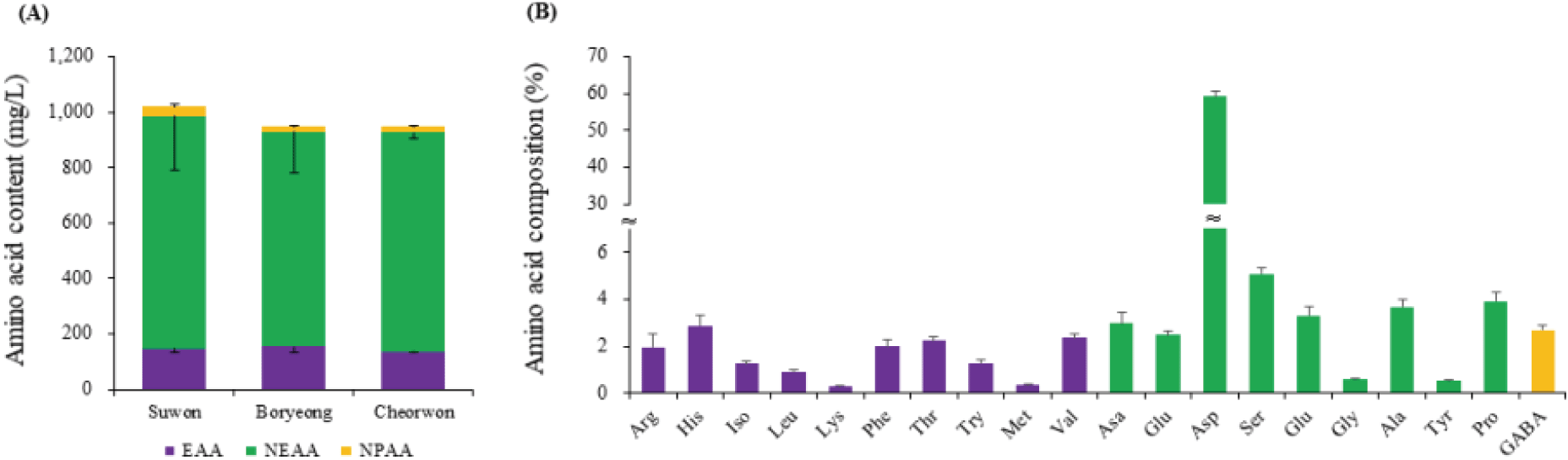
세 지역에서 화밀 내 아미노산 함량(mg/L)을 필수 아미노산(Essential Amino Acids, EAA), 비필수 아미노산(Non-Essential Amino Acids, NEAA) 및 비단백질 아미노산(Non-Proteinogenic Amino Acids, NPAA)으로 구분하여 분석하였다[Figure 4(A)]. 단위 용량당 총 아미노산 함량은 수원 지역이 1020.6±217.2 mg/L로 가장 높았고, 보령과 철원 지역이 각각 949.1±67.5 mg/L과 949.2±26.2 mg/L로 나타났으며, 지역간 유의미한 차이는 인정되지 않았다. 세 지역의 평균 단위용량당 아미노산 함량은 973.0±80.4 mg/L였으며, 구성비는 필수 아미노산이 15.5%(146.4±8.5 mg/L), 비필수 아미노산이 81.8%(800.2±72.5 mg/L)였다.
Figure 4.
Amino acid content (A) and composition (B) in floral nectar of R. pseudoacacia. Explanations: Arg-Arginine, His-Histidine, Iso-Isoleucine, Leu-Leucine, Lys-Lysine, Phe-Phenylalanine, Thr-Threonine, Try-Tryptophane, Met-Methionine, Val-Valine, Asa-Aspartic acid, Glua-Glutamic acid, Asp-Asparagine, Ser-Serine, Glu-Glutamine, Gly-Glycine, Ala-Alanine, Tyr-Tyrosine, Pro-Proline.
Download Original Figure
아까시나무의 화밀에는 10종류의 필수 아미노산과 9종류의 비필수 아미노산, 그리고 1종류의 비단백 아미노산이 검출되었으며[Figure 4(B)], Asparagine(59.2%)이 가장 많이 함유된 것으로 나타났다. 한편, 2% 이상의 구성비를 가진 필수 아미노산은 Arginine(2.0%), Histidine(2.9%), Phenylalanine(2.0%), Threonine(2.2%) 이었으며, 비필수 아미노산은 Serine(5.1%), Proline(3.9%), Alanine(3.7%), Aspartic acid(3.0%), Glutamic acid(2.5%)이었다. 비단백질 아미노산은 GABA만 검출되었으며, 전체 아미노산 함량의 2.7%를 차지하고 있었다.
5. 잠재적 꿀 생산량
근원경에 따른 수관폭과 본당 개화량을 회귀식을 통해 산출하고, 단위 면적당 생육가능 본수와 이에 따른 잠재적 꿀 생산량을 추정하였다(Table 2). 근원경이 5 cm 일 때 수관폭은 3.0 m, 본당 개화량은 11,626개로 추정되었으며, 잠재적 꿀 생산량은 24.9 kg였다. 반면, 근원경이 30 cm일 때 수관폭은 8.5 m로 개화량은 91,941개로 가장 많았으나, 수관폭이 증가함에 따라 생육가능 본수가 138본으로 감소하여 잠재적 꿀 생산량은 근원경 5 cm 일 때와 동일한 24.9 kg이었다. 가장 우수한 단위 면적당 잠재적 꿀 생산량은 근원경이 10 cm일 때로 ha당 31.9 kg의 꿀을 생산할 수 있는 것으로 추정되었으며, 5~30 cm 범위의 평균적인 아까시나무의 꿀 생산량은 28.3 kg으로 나타났다.
Table 2.
Estimated honey productions by diameter at root of R. psedouacacia.
|
Diameter of root (cm) |
Diameter of crown (m) |
No. of flower (ea/tree) |
No. of trees (ea/ha) |
Honey production (kg/ha) |
|
5 |
3.0 |
11,626 |
1,094 |
24.9 |
|
10 |
4.1 |
27,689 |
589 |
31.9 |
|
15 |
5.2 |
43,752 |
368 |
31.5 |
|
20 |
6.3 |
59,815 |
251 |
29.4 |
|
25 |
7.4 |
75,878 |
182 |
27.1 |
|
30 |
8.5 |
91,941 |
138 |
24.9 |
Download Excel Table
고 찰
1. 잠재적 꿀 생산량 평가
본 연구는 국내 천연꿀 생산량의 약 70%를 차지한다고 알려진 아까시나무의 정량적 밀원가치를 평가하였다. 이를 위해 다수의 조사목을 대상으로 생장 특성과 개화량을 조사하였으며, 화밀 분비량, 꽃 하나당 유리당 함량을 분석하여 생장 특성별 단위 면적당 잠재적 꿀 생산량을 추정하였다. 그 결과, 아까시나무의 ha당 꿀 생산량은 다양한 생장 특성에 따라 24.9~31.9 kg/ha 범위의 잠재적 꿀 생산량을 보였다(Table 2). 이는 Carl et al.(2017)이 독일의 아까시나무 조림지를 대상으로 평가한 69 kg/ha와 다소 차이가 있었지만, Vakulyuk(1991)가 보고한 우크라이나 아까시나무의 꿀 생산추정량 33~47 kg/ha와는 유사하게 나타났다. 다만, 국가별 생육 특성 및 조사방법의 차이로 인해 본 연구결과와 직접적인 비교는 적절하지 않은 것으로 판단되며, 본 연구결과는 국내 자생 아까시나무의 잠재적 꿀 생산량을 정량적으로 평가한 첫 연구라는 점에서 의미가 있다.
한편, 모든 밀원식물의 꿀 생산성은 동일하지 않으며(Dmitruk et al., 2021; Fishchuk and Odintsova, 2021), 품종 간에도 차이가 있다(Bertazzini and Forlani, 2016; Na et al., 2024a). 따라서 밀원가치 평가는 각 수종마다 개별적인 연구가 필요하며, 수종 간 비교는 동일한 측정 기준을 적용한 연구에만 한정되어야 한다(Na et al., 2024a). 특히, 지역 또는 국가 단위에서 이루어지는 대규모 밀원단지를 조성하기 위해 수종 선정은 동일한 측정 방법을 적용해 추정된 잠재적 꿀 생산량에 기반하여 신중하게 선택해야 한다(Adgaba et al., 2017). 따라서 본 연구와 동일한 평가 방법이 적용된 수종들의 잠재적 꿀 생산량을 선행연구 결과를 바탕으로 아까시나무의 밀원가치를 평가하고자 한다. Kim et al.(2021a, 2021b)은 동백나무의 잠재적 꿀 생산성을 37.7 kg/ha로, 명자나무의 경우 31.1 kg/ha로 보고하였으며, 남부권역에서 유망한 밀원수로 평가된 광나무와 아왜나무의 ha당 잠재적 꿀 생산량은 각각 120.4 kg과 125.4 kg으로 보고하였다(Kim et al., 2022). 한편, Na et al.(2024b)은 국내 8 수종의 밀원 가치를 평가한 결과에서 피나무 87.6 kg/ha, 칠엽수 71.8 kg/ha, 칠자화 41.1 kg/ha의 잠재적 꿀 생산량을 보고하였다. 이에 국내에는 아까시나무보다 우수한 밀원수가 다수 존재함으로 관행적으로 이어진 아까시나무 위주의 밀원숲 조성에 대한 정책적 재검토가 필요하다고 생각된다.
2. 화밀 품질 평가
화밀은 꽃 내부에 존재하는 밀선(nectary)에서 분비되는 당 화합물로 대부분 당과 수분으로 구성되지만 소량의 아미노산, 미네랄, 2차 대사산물이 포함되어 있다(Adler, 2000; Nepi et al., 2012; Afik et al., 2006). 화밀의 당(nectar sugar)은 주로 자당(sucrose), 포도당(glucose) 및 과당(fructose)으로 이루어져 있다(Pavlik et al., 2018). 본 연구에서 아까시나무의 화밀은 자당이 60% 이상, 포도당은 약 20~30%, 그리고 과당은 약 10%로 구성된 것으로 나타났으며(Figure 3). 이는 sucrose와 hexose (glucose + fructose) 비율에 따라 화밀 품질을 4개 등급으로 구분한 기준(Cnaani et al., 2006)을 적용할 때, 아까시나무는 sucrose-dominant 등급에 해당된다. 꿀벌은 자당으로만 이루어진 화밀보다는 다양한 당이 혼합된 화밀을 선호하는 것으로 알려져 있으며(Afik et al., 2006), 단일 당 구성 측면에서는 자당 > 포도당 > 맥아당 > 과당 순으로 선호하는 경향이 있다(Wykes, 1952). 또한 화밀 내 자당 비율이 50% 이상일 경우 꿀벌의 체류 시간이 증가한다(Petanidou et al., 2006)는 선행연구를 고려하였을 때, 아까시나무 화밀은 꿀벌의 선호도가 높은 당 구성을 가진 것으로 판단된다.
화밀의 아미노산 역시 화분매개자의 핵심 영양소로(Nicolson and Thornburg, 2007; Nepi et al., 2012), 비록 화밀에 매우 낮은 함량으로 존재하지만(Lohaus and Schwerdtfeger, 2014; Nicolson, 2022), 화밀의 품질을 결정하는 주요 인자이다(Park and Thornburg, 2009). 각각의 아미노산이 화분매개자에게 미치는 생물학적 영향에 대해서는 아직 명확하지 않다(Nicolson, 2022). 하지만 꿀벌의 먹이공급을 통제하는 실험에서 다양한 아미노산을 섭취한 꿀벌이 수명과 생식 능력이 향상되며(Mevi-Schutz and Erhardt, 2005), 기억력과 학습력이 개선되는 효과가 있었다(Chalisova et al., 2011; Simcock et al., 2014)는 점에서 단순한 영양학적 이상의 가치가 있다고 판단된다(Nepi et al., 2012). de Groot (1953)은 체내에서 합성하거나 다른 아미노산으로부터 전환될 수 없어 반드시 화밀 등 먹이자원으로부터 섭취해야 하는 꿀벌의 10가지 필수 아미노산에 대해 보고하였는데, 본 연구에서 확인된 아까시나무의 화밀에는 필수 아미노산 10가지가 모두 존재하는 것으로 나타났다(Figure 4). 아울러, 아까시나무 화밀에 가장 많이 함유된 Asparagine (59.2%)은 화분매개자에게 질소 공급원의 역할을 하며(Petanidou et al., 2006), 두 번째로 많이 함유된 Serine(5.1%)은 꿀벌에게 유해한 미생물을 억제하는 기능이 있다(Ligoxygakis et al., 2002; Vannette et al., 2015). 또한 Proline(3.9%)은 꿀벌이 비행 시 사용하는 에너지원으로 산화과정에서 빠르게 대사되어 많은 양의 ATP를 방출해 채밀을 위해 장거리를 이동하는 꿀벌에게 큰 이점을 제공하며(He et al., 2018), 꿀벌이 가장 선호하는 아미노산 중 하나로 알려져 있다(Bertazzini et al., 2010; Hendriksma et al., 2014). 또한 Aspartic acid(3.0%)와 Glutamic acid(2.5%)는 꿀벌의 산화 스트레스를 감소시키는 역할을 한다(Anraku et al., 2015; Duan et al., 2016). 한편, 아까시나무에 2.7% 함유된 GABA는 다양한 식물의 화밀에서 발견되는 대표적인 비단백질 아미노산으로(Bell, 2003; Silva et al., 2020), 곤충의 후각 처리 및 학습에 필수적인 기능을 수행하며(Sachse and Galizia., 2002; Raccuglia and Mueller, 2013), 꿀벌의 기억 능력을 향상시키는 것으로 알려져 있다(Carlesso et al., 2021). 이상의 결과를 종합할 때, 아까시나무의 화밀은 꿀벌의 생장과 활동에 필요한 아미노산을 원활히 공급할 수 있는 특성을 가졌다고 평가된다.
결 론
세 지역에서 생육 중인 아까시나무의 꽃 하나당 화밀 분비량은 1.5~3.0 μL 범위로 생육 지역에 따라 변동성이 있지만, 최종적으로 양봉산물 생산과 꿀벌 먹이자원으로 활용되는 꽃 하나당 유리당 함량은 지역간 차이가 없었다. 화밀 내 자당의 구성비는 60% 이상으로 꿀벌의 선호도가 높은 특성을 가진 것으로 나타났다. 또한 화밀에는 꿀벌의 필수 아미노산 10종이 모두 존재하였으며, 이는 아까시나무 화밀이 화분매개자의 질소 공급원으로서 영양학적 요구를 충족시킬 수 있는 것으로 평가된다. 다양한 생장 특성을 가진 상황에서 추정된 잠재적 꿀 생산량은 22.6~37.6 kg/ha였으며, 이러한 결과는 양봉산물 생산을 위한 밀원숲 조성에 아까시나무의 활용 여부를 재검토할 필요가 있다고 생각된다. 본 연구는 국내 아까시나무의 생육, 개화 및 화밀 특성을 종합적으로 분석하여, 잠재적 꿀 생산량을 정량적으로 평가하고 화분매개자 먹이 공급 측면의 생태적 가치를 제시하였다는데 의의가 있다.
감사의 글
본 연구는 국립산림과학원 산림과학연구사업(FG0403-2023-01-2025)의 지원에 의해 수행되었습니다.
References
Adgaba, N., Al-Ghamdi, A., Tadesse, Y., Getachew, A., Awad, A.M., Ansari, M.J., Owayss, A.A., Mohammed, S.E.A. and Alqarni, A.S. 2017. Nectar secretion dynamics and honey production potentials of some major honey plants in Saudi Arabia. Saudi Journal of Biological Sciences, 24(1): 180-191.




Adler, L.S. 2000. The ecological significance of toxic nectar. Oikos 91(3): 409-420.


Afik, O., Dag, A., Kerem, Z. and Shafir, S. 2006. Analyses of avocado (
Persea americana) nectar properties and their perception by honeybees (
Apis mellifera). Journal of Chemical Ecology 32: 1949-1963.



Anraku, M., Shintomo, R., Taguchi, K., Kragh-Hansen, U., Kai, T., Maruyama, T. and Otagiri, M. 2015. Amino acids of importance for the antioxidant activity of human serum albumin as revealed by recombinant mutants and genetic variants. Life Sciences 134: 36-41.



Armstrong, D.P., Paton, D.C. 1990. Methods for measuring amounts of energy available from banksia inflorescences. Australian Journal of Ecology 15(3): 291-297.


Bareke, T., Addi, A., Wakjira, K. and Kumsa, T. 2021. Dynamics of nectar secretion, honey production potential and colony carrying capacity of
Coffeaarabica L. (Rubiaceae). Journal of Agriculture and Environment for International Development 115(1): 125-138.

Baude, M., Kunin, W.E., Boatman, N.D., Conyers, S., Davies, N., Gillespie, M.A.K., R. Morton, D., Smart, S.M. and Memmott, J. 2016. Historical nectar assessment reveals the fall and rise of floral resources in Britain. Nature 530(7588): 85-88.




Bertazzini, M. and Forlan, G. 2016. Intraspecific variability of floral nectar volume and composition in rapeseed (
Brassica napus L. var.
oleifera). Frontiers Plant Science 7: 288.




Bertazzini, M., Medrzycki, P., Bortolotti, L., Maistrello, L. and Forlani, G. 2010. Amino acid content and nectar choice by forager honeybees (
Apis mellifera L.). Amino Acids 39: 315-318.



Biella, P., Akter, A., Muñoz-Pajares, A.J., Federici, G., Galimberti, A., Jersáková, J., Labra, M., Mangili, F., Tommasi, N. and Mangili, L. 2021. Investigating pollination strategies in disturbed habitats: the case of the narrow-endemic toadflax
Linaria tonzigii (Plantaginaceae) on mountain screes. Plant Ecology 222: 511-523.


Bożek, M., Denisow, B., Strzałkowska-Abramek M,, Chrzanowska, E. and Winiarczyk, K. 2023. Non-forest woody vegetation: a critical resource for pollinators in agricultural landscapes-a review. Sustainability 15(11): 8751.


Braman, S.K. and Griffin, B. 2022. Opportunities for and impediments to pollinator conservation in urban settings: a review. Journal of Integrated Pest Management 13(1): 6.


Broyles, S.B. and Stoj, K.R. 2019. Patterns of nectar production in
Asclepias curassavica (Apocynaceae). Journal of Pollination Ecology 25: 78-88.


Carl, C., Landgraf, D., Van der Maaten-Theunissen, M., Biber, P. and Pretzsch, H. 2017. Robinia pseudoacacia L. flower analyzed by using an Unmanned Aerial Vehicle (UAV). Remote Sensing, 9(11): 1091.


Cavalcante, M.C., Galetto, L., Maues, M.M., Pacheco Filho, A.J.S., Bomfim, I.G.A. and Freitas, B.M. 2018. Nectar production dynamics and daily pattern of pollinator visits in Brazil nut (
Bertholletia excelsa Bonpl.) plantations in Central Amazon: Implications for fruit production. Apidologie 49: 505-516.


Chalisova, N.I., Kamyshe, N.G., Lopatina, N.G., Kontsevaya, E.A., Urtieva S.A. and Urtieva, T.A. 2011. Effect of encoded amino acids on associative learning of honey bee:
Apis mellifera. Journal of Evolutionary Biochemistry and Physiology 47(6): 607-610.


Cnaani, J., Thomson, J.D. and Papaj, D.R. 2006. Flower choice and learning in foraging bumblebees: Effects of variation in nectar volume and concentration. Ethology 112(3): 278-285.


de Groot, A.P. 1953. Protein and amino acid requirements of the honey bee (
Apis mellifera L.). Physiologia comparata et oecologia 3: 197-285.

Dmitruk, M., Wrzesień, M., Strzałkowska-Abramek, M. and Denisow, B. 2021. Pollen food resources to help pollinators. A study of five Ranunculaceae species in urban forest. Urban Forestry & Urban Greening 60: 127051.


Donkersley, P. 2019. Trees for bees. Agriculture, Ecosystems and Environment 270-271: 79-83.


Filipiak, M. 2019. Key pollen host plants provide balanced diets for wild bee larvae: a lesson for planting flower strips and hedgerows. Journal of Applied Ecology 56(6): 1410-1418.


Filipiak, M., Kuszewska, K., Asselman, M., Denisow, B., Stawiarz, E., Woyciechowski, M. and Weiner, J. 2017. Ecological stoichiometry of the honeybee: pollen diversity and adequate species composition are needed to mitigate limitations imposed on the growth and development of bees by pollen quality. Plos One 12(8): e0183236.




Fishchuk, O. and Odintsova, A. 2021. Micromorphology and anatomy of the flowers in
Clivia spp. and
Scadoxus multiflorus (Haemantheae, Amaryllidaceae). Acta Agrobotanica 74(1): 7417.


Garibaldi, L.A., Sáez, A., Aizen, M.A., Fijen, T. and Bartomeus, I. 2020. Crop pollination management needs flower-visitor monitoring and target values. Journal of Applied Ecology 57(4): 664-670.


Han, J., Kang, M.S., Kim, S.H., Lee, K.Y. and Baik, E.S. 2009. Flowering, honeybee visiting and nectar secretion characteristics of
Robinia pseudoacacia L. in Suwon, Gyeonggi Province. Journal of Apiculture 24: 147-152.

He, Y.-L., Shi, J.-Y., Peng, C., Hu, L.-J., Liu, J., Zhou, Q.-M., Guo, L. and Xiong, L. 2018. Angiogenic effect of motherwort (
Leonurus japonicus) alkaloids and toxicity of motherwort essential oil on zebrafish embryos. Fitoterapia 128: 36-42.



Isbell, F., Adler, P.R., Eisenhauer, N., Fornara, D., Kimmel, K., Kremen, C., Letourneau, D.K., Liebman, M., Polley, H.W., Quijas, S. and Scherer-Lorenzen, M. 2017. Benefits of increasing plant diversity in sustainable agroecosystems. Journal of Ecology 105(4): 871-879.


Jachuła, J., Denisow, B. and Strzałkowska-Abramek, M. 2019. Floral reward and insect visitors in six ornamental
Lonicera species - Plants suitable for urban bee-friendly gardens. Urban Forestry & Urban Greening 44: 126390.


Jung, J.W., Lee, H.S., Noh, G.R., Lee, A., Kim, M.S., Kim,, S.H. and Kwon, H.W. 2017. Comparative study on the composition of floral volatile components in the flowering stages of Robinia pseudoacacia L. Journal of Apiculture 32(3): 139-146.


Kim, Y.K., Na, S.J., Kwon, H.Y. and Park, W.G. 2022. Evaluation of honey production of
Ligustrum japonicum and
Viburnum odoratissimum var.
awabuki in the southern part of Korea. Journal of Apiculture 37: 35-44.


Kim, Y.K., Yoo, H.W., Kwon, H.Y. and Na, S.J. 2021a. Honeybee foraging activity and evaluation of honey value from
Chaenomeles speciosa (sweet) Nakai. Journal of Apiculture 36(3): 161-168.


Kim, Y.K., Yoo, H.W., Park, M.S., Kwon, H.Y., Kim, M.J. and Na, S.J. 2021b. Evaluation of honey production of
Camellia japonica L. Journal of Apiculture 36(3): 149-159.


Lee, C.-S., Cho, H.-J. and Yi, H. 2004. Stand dynamics of introduced black locust (
Robinia Pseudoacacia L.) plantation under different disturbance regimes in Korea. Forest Ecology and Management 189(1-3): 281-293.


Lee, S., Kim, Y., Noh, G.R., Lee, H.S., Kim, M.S., Kim, S.H. and Kwon. H.W. 2019. Comparative study of floral volatile components in the different species of
Robinia spp. Journal of Apiculture 34(3): 189-195.



Lohaus, G. and Schwerdtfeger, M. 2014. Comparison of sugars, iridoid glycosides and amino acids in nectar and phloem sap of
Maurandya barclayana,
Lophospermum erubescens, and
Brassica napus. PLOS One 9(1): e87689.




Na, S.J., Park, J.M. and Kim, Y.K. 2024b. Selection of urban trees to enhance pollinator food resources: comprehensive consideration of various factors for productivity comparison. Preprints 2024090153.


Nepi, M., Soligo, C., Nocentini, D., Abate, M., Guarnieri, M., Cai, G., Bini, L., Puglia, M., Bianchi, L. and Pacini, E. 2012. Amino acids and protein profile in floral nectar: Much more than a simple reward. Flora - Morphology, Distribution, Functional Ecology of Plants 207(7): 475-481.


Nicolson, S.W. and Thornburg, R.W. Nectar chemistry. In nectaries and nectar; Nicolson, S.W., Nepi, M., Pacini, E., Eds.; Springer: Dordrecht, The Netherlands, 2007; pp. 215-264.


Ollerton, J., Winfree, R. and Tarrant, S. 2011. How many flowering plants are pollinated by animals. Oikos 120(3): 321-326.


Park, S. and Thornburg, R.W. 2009. Biochemistry of nectar proteins. Journal of Plant Biology 52: 27-34


Pavlik, D.T., Fleishman, E., Wang, N., Boswell, P. and Blair, R.B. 2018. Sugars in nectar sources and their use by butterflies (Hesperioidea and Papilionoidea) in the Sierra Nevada, California. The Journal of the Lepidopterists’ Society 72(2): 165-174.


Petanidou, T., Van Laere, A., Ellis, W.N. and Smets, E. 2006. What shapes amino acid and sugar composition in Mediterranean floral nectars?. Oikos 115(1): 155-169.


Phillipsa, B.B., Wallaceb, C., Robertsa, B.R., Whitehousec, A.T., Gastona, K.J., Bullockd, J.M., Dicksb, L.V. and Osborne, J.L. 2020. Enhancing road verges to aid pollinator conservation: A review. Biological Conservation 250: 108687.


Potts, S.G., Biesmeijer, J.C., Kremen, C., Neumann, P., Schweiger, O. and Kunin, W.E. 2010. Global pollinator declines: trends, impacts and drivers. Trends in Ecology & Evolution 25(6): 345-353.



Silva, F.A., Chatt, E.C., Mahalim, S.-N., Guirgis, A., Guo, X., Nettleton, D.S., Nikolau, B.J. and Thornburg, R.W. 2020. Metabolomic Profiling of
Nicotiana Spp. Nectars indicate that pollinator feeding preference is a stronger determinant than plant phylogenetics in shaping nectar diversity. Metabolites 10(5): 214.




Sirohi, M.H., Jackson, J., Edwards, M. and Ollerton, J. 2015. Diversity and abundance of solitary and primitively eusocial bees in an urban centre: a case study from Northampton (England). Journal of Insect Conservation 19: 487-500.


Sutter, L., Jeanneret, P., Bartual, A.M., Bocci, G. and Albrecht, M. 2017. Enhancing plant diversity in agricultural landscapes promotes both rare bees and dominant crop-pollinating bees through complementary increase in key floral resources. Journal of Applied Ecology 54(6): 1856-1864.


Tew, N.E., Memmott, J., Vaughan, I.P., Bird, S., Stone, G.N., Potts, S.G. and Baldock, K.C.R. 2021. Quantifying nectar production by flowering plants in urban and rural landscapes. Journal of Ecology 109(4): 1747-1757.


Vakulyuk, P.G. 1991. Stories about the trees. Kyiv, Urozhay, p 296 (in Ukrainian)

Wykes, G.R. 1952. The preferences of honey bees for solutions of various sugars which occur in nectar. Journal of Experimental Biology 29(4): 511-519.