서 론
산림의 생물다양성이 높아지며 발견할 수 있는 다양한 초본류 중, 산업화가 진행되고 국가 간의 교류 및 무역이 활발해지면서 외래식물 또한 늘어나고 있다. 외래식물은 ‘원예나 재배 등의 목적으로 들여온’ 도입식물(introduced plant)과 ‘인위적 또는 자연적으로 들어와서 도태되지 않고 토착화된’ 귀화식물(naturalized plant)로 나눌 수 있으며, 귀화식물은 다시 개항(1876년)을 기점으로 사전귀화식물과 신귀화식물로 나뉜다(Korea National Arboretum, 2012). 전국의 산기슭과 임도, 수목이 벌채된 곳이나 들판에서 흔히 볼 수 있는 덩굴성 식물 중의 하나인 환삼덩굴은 삼과의 한해살이풀로 우리나라 및 일본, 타이완, 중국, 아무르, 우수리 등 동북아시아 지역에 주로 분포한다(Lee, 2007). 땅을 기거나 다른 식물의 위를 덮으며 자라는 원줄기와 잎자루에는 잔가시가 있어 거칠고, 잎은 줄기에 마주나며 잎자루 끝에서 손바닥 모양으로 5~7개로 갈라지고 양면에 거친 털이 있다(Lee, 2003). 환삼덩굴을 귀화식물로 분류하는 연구사례도 있으나(Song et al., 2010), 실제 환삼덩굴의 약명인 율초(葎草)가 1610년 저술된 허준의 동의보감에도 기록되어 있고(Heo, 2007) 주 분포지가 동북아시아 지역이라는 이유 등으로, 환삼덩굴을 자생식물로 보아야 한다는 견해 또한 있다.
환삼덩굴(Humulus japonicus Sieboid & Zucc.)은 오림(五淋)을 주로 치료하여 소변을 잘 나오게 하고, 그 성분으로는 humulone, lupulone, humuladienone, humulenone-Ⅱ, tannin, 정유, 수지 등이 알려졌다(Ahn, 2003). 환삼덩굴 관련 연구로는 항염증에 관한 연구(Hwang et al., 2009) 및 메탄올 추출물에 관한 연구(Lee et al., 2012) 등이 이루어졌으며, 환삼덩굴의 부위별 추출물의 LC-MS/MS를 통한 폴리페놀 구성분석(Choi et al., 2018), 환삼덩굴 추출물을 함유한 기능성 화장품의 유효성·안전성 평가를 위한 임상연구(Park et al., 2019) 환삼덩굴로부터 유래된 glycosyl flavones의 광노화 억제작용(Nam et al., 2020) 등 기능성 화장품과 건강 기능성 식품 등으로 사용하기 위한 연구가 진행되고 있다. 또한 환삼덩굴의 잎과 줄기의 화학성분(Hur et al., 2003) 연구와 환삼덩굴 분리정제물의 연구(Park et al., 2000)를 보았을 때, 환삼덩굴의 에탄올 및 열수 추출물의 생리활성은 높게 나타날 것으로 예상되었다. 또한 식물재료는 채취 시기별로 그 활성이 달라질 수 있으므로(Choi et al., 2010; Lee et al., 2010) 채취 시기별 생리활성 비교연구는 필요하다고 판단되었다.
이에 본 연구에서는 환삼덩굴 지상부를 채취하여 추출한 2가지 추출물(에탄올 추출물, 열수 추출물)을 이용하여 연구를 진행하였으며, 항산화 활성과 주름 개선 및 미백 활성을 확인하여 기능성 화장품과 바이오 제품의 기능성 소재로서의 가능성을 확인하고자 하였다. 또한 환삼덩굴의 국내 평균 개화기인 7월을 기점으로(Lee, 2003) 개화 전인 6월과 개화 후인 8월의 시료를 각각 채취하여 활성을 비교해 보았다.
재료 및 방법
추출에 사용한 환삼덩굴 시료는 경기도 화성시 황구지천 인근 지역에서 자생하는 것을 6월 및 8월경에 채취하여 실내 음지에서 건조한 후 분쇄한 것을 사용하였다. 생리활성 실험에 사용된 시약은 Folin-ciocalteu’s reagent, 1,1-diphenyl-2-picrylhydrazyl, Tris-base, pyrogallol, 2,2-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt, potassium persulfate, 3,4-Dihydroxy-L-phenylalanine (L-DOPA), mushroom tyrosinase, elastase, N-succinyl- (L-ala)3 -p-nitroanilide, hemoglobin from bovine blood 등으로 Sigma-Aldrich에서 구매하여 사용하였다. 세포 독성 측정 및 NO 생성억제 측정에 사용된 세포주는 melanoma cell인 B16F10, macrophage cell인 Raw 264.7이며 ATCC에서 구매하여 사용하였다. 세포 배양에 사용한 dulbecco`s modified eagle medium (DMEM), fetal bovine serum (FBS), phosphate buffered saline (PBS), penicillin/ streptomycin, trypsin은 Thermo Scientific Hyclone (USA) 및 Gibco BRL Co. (Grand Island, USA)에서 구매하여 사용하였다. NO assay에 사용한 lipopolysaccharides (LPS)와 Griess 시약, 세포 독성 측정에 사용된 hemocytometer (Marienfeld, Germany)와 3-[4,5-dimethylthiazol]-2-yl]-2,5-diphenyl-tetrazoliumbromide (MTT)은 Sigma-Aldrich Co. (St. Louis, MO, USA)에서 구매하였으며, dimethyl sulfoxide (DMSO)는 BioShop (Canada)에서 구매하여 사용하였다.
환삼덩굴 시료는 채취 시기에 따라 구분하여 열수 및 70% 에탄올로 추출하였다. 열수 추출은 건조 시료 중량의 10배수의 증류수를 넣어 100°C에서 24시간 가열하여 추출액과 분리한 후 같은 시료에 같은 양의 용매를 넣어 1회 추가로 추출하여 혼합하였으며, 70% 에탄올 추출은 건조 시료 중량의 10배수의 70% 에탄올을 넣어 24시간 담가 추출 후 추출액과 분리한 후 같은 시료에 같은 양의 용매를 넣어 2회 추가로 추출 후 혼합하였다. 시료와 분리된 추출액은 여과지로 여과 후 감압농축 및 동결건조를 시행하였으며 동결건조물은 –25°C에서 보관하며 실험재료로 사용하였다.
시료 추출물의 총 폴리페놀 함량은 Folin-Denis 방법을 응용하여 측정하였다(Folin and Denis, 1912; Smeriglio et al., 2016). 5,000 μg/mL로 희석한 추출물 10 μL을 정량하여 10% sodium carbonate (Na2CO3) 200 μL와 1N Folinciocalteu’s reagent 10 μL와 혼합 후 상온에서 30분 반응하여 750 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 gallic acid를 표준물질로 한 표준곡선을 이용하여 계산하였다.
전자공여능(EDA: electron donating abilities)은 Blois의 방법을 응용하여 측정하였다(Blios, 1958). 1,1-diphenyl-2-picrylhydrazyl (DPPH) 60 μL와 농도별 추출물을 120 μL씩 넣고 혼합 후 15분간 방치하였다. 이후 microplate reader를 사용하여 517 nm에서 흡광도를 측정하였다. 전자공여능은 시료 용액의 첨가구와 무첨가구의 흡광도 감소율로 나타내었다.
추출물의 SOD 유사활성은 Marklund 등의 방법을 응용하여 측정하였다(Marklund and Marklund, 1974). 농도별 시료 용액 20 μL에 Tris-HCl 완충용액(50 mM Tris-HCl buffer, pH 8.5) 130 µL와 7.2 mM pyrogallol 20 µL을 넣고 혼합 후 37°C에서 10분 동안 반응시켰다. 이후 산화된 pyrogallol 양을 microplate reader를 사용하여 420 nm에서 흡광도를 측정하였다.
추출물의 ABTS+ radical 소거능은 Pellegrin 등의 방법을 응용하여 측정하였다(Pellegrin et al., 1998). 2.45 mM potassium persulfate와 7 mM 2,2-azino-bis(3-ethylbenthiazoline-6-sulfonic acid)를 혼합 후 실온에서 24시간 방치하여 형성된 ABTS+ radical 용액을 100% ethanol로 희석한 용액 100 µL에 농도별 추출물 100 µL을 혼합 후 735 nm에서 흡광도를 측정하였다.
Tyrosinase 저해활성 측정은 Yagi 등의 방법을 적용하여 측정하였다(Yagi et al., 1987). 시료 용액 40 µL에 67 mM sodium phosphate buffer (pH 6.8) 80 µL에 10 mM L-DOPA 40 µL 및 mushroom tyrosinase (200 U/ml) 40 µL을 첨가하여 37°C에서 10분간 반응시켰다. 이후 반응액 가운데 생성된 DOPA chrome을 490 nm에서 측정하였다. Tyrosinase 저해활성은 시료 용액의 첨가구와 무첨가구의 흡광도 감소율로 나타내었다.
Elastase 저해활성 측정은 Cannell 등의 방법을 응용하여 측정하였다(Cannell et al., 1988). 기질로서 N-succinyl-(L-ala)3-p-nitroanilide를 사용하였으며, 37°C에서 30분 동안 생성된 p-nitroanilide의 생성량을 445 nm에서 측정하였다. 즉, 각 시험용액을 일정 농도가 되도록 제조하여 40 µL을 취한 뒤 50 mM tris-HCl buffer (pH 8.6)에 녹인 porcine pancreas elastase (0.5 U/ml) 용액 40 µL에 0.4 M tris-HCl buffer (pH 8.6) 40 µL을 첨가하여 37°C에서 2분 가열한 후 기질로 50 mM tris-HCl buffer (pH 8.6)에 녹인 N-succinyl-(L-ala)3-p-nitroanilide (3.2 mM)을 80 µL 혼합하여 30분간 반응시켜 측정하였다. Elastase 저해활성은 시료 용액의 첨가구와 무첨가구의 흡광도 감소율로 나타내었다.
피부수렴 활성은 Lee 등의 방법을 적용하여 측정하였다(Lee et al., 2002). 일정 농도가 되도록 제조한 시료 용액 0.5 mL과 1X PBS에 녹인 0.5% hemoglobin 용액 0.5 mL를 혼합하여 1분간 진탕 혼합한 후 1500 rpm에서 3분간 원심분리하였다. 이후 상등액 150 µL을 취하여 575 nm에서 흡광도를 측정하였다.
아래 실험들에 이용한 각 세포의 배양을 위하여 10% FBS와 1% penicillin/streptomycin (100 U/mL)을 첨가한 DMEM 배지를 사용하였으며, 37°C, 5% CO2 incubator에 적응시켜 계대 배양하였다.
세포 독성 측정 실험은 Carmichael의 방법(Carmichael et al., 1987)을 적용하여 시행하였다. 세포 독성을 측정할 세포(B16F10)를 96 well plate에 2×106 cells/well이 되도록 180 µL 분주한 후, 농도 별로 제조한 시료 용액 0.02 mL를 넣은 후 37°C, 5% CO2 incubator에서 24시간 배양하였다. 대조군은 시료 용액과 같은 양의 무혈청 배지를 혼합하여 같은 조건에서 배양하였다. 여기에 2.5 mg/mL 농도로 제조한 MTT용액 40 µL을 혼합하여 37°C, 5% CO2 incubator에서 다시 3시간 배양한 후 배양액을 제거하고 각 well 당 DMSO 100 µL를 가하여 실온에서 30분간 반응시킨 후 microplate reader로 540 nm에서 흡광도를 측정하였다. 세포 생존율은 시료 첨가군과 무첨가군의 흡광도 감소율로 표현하였다. 세포 생존율 측정은 시료 용액의 첨가구와 무첨가구의 흡광도 감소율로 나타내었다.
NO 생성 저해는 Green 등의 방법(Green et al., 1982)으로 측정하였다. 96 well plate에 Raw 264.7 cell을 2×106 cells/well이 되도록 200 µL씩 분주하였으며 37°C, 5% CO2 incubator에서 24시간 배양하였다. 그 후 1X PBS로 2번 washing 후 lipopolysaccharide (LPS) 1 µg/mL을 normal을 제외한 모든 well에 넣어 자극하였다. 2시간 이후 농도 별로 제조한 시료 용액을 처리하여 24시간 배양한 후 상등액을 griess regent와 실온에서 10분 반응시킨 후 540 nm에서 흡광도를 측정하였다. NO 억제능의 결과는 시료 첨가군과 무첨가군의 흡광도 감소율로 표현하였다.
결과 및 고찰
식물에 함유된 폴리페놀, 플라보노이드 등의 페놀성 화합물은 분자 내에 하나 또는 두 개 이상의 수산기로 치환된 방향족 환인 phenolic hydroxyl (OH)기를 가지고 있다. 분자의 phenolic hydroxyl기의 수는 페놀성 화합물의 항산화 활성에 영향을 주는 것으로 알려져 있으며 이에 따라 폴리페놀의 함량이 증가함에 따라 항산화 활성 또한 증가한다는 연구 결과가 다수 존재한다. 또한 페놀류 화합물의 phenolic hydroxyl기는 효소 단백질과 결합하여 다양한 약리 활성을 나타낸다는 사실 또한 널리 알려져 있다(Husain et al., 1987; Lee et al., 1996; Choi et al., 2005; Lee et al., 2005; Choi et al., 2006).
환삼덩굴 추출물의 총 폴리페놀 함량을 측정한 결과는 Table 1과 같다. 환삼덩굴 추출물의 총 폴리페놀 함량은 6월에 채취한 환삼덩굴의 열수 추출물이 41.09 mg/g GAE, 같은 시기에 채취한 70% 에탄올 추출물이 56.64 mg/g GAE를 나타내었으며, 8월에 채취하여 추출하였을 때 열수 추출물은 31.56 mg/g GAE, 에탄올 추출물은 31.81 mg/g GAE의 함량을 나타내어, 열수와 에탄올 추출물 모두 6월에 채취하여 추출한 것의 총 폴리페놀 함량이 높게 나타났으며, 채취 시기가 같은 경우 열수 추출물보다 70% 에탄올 추출물의 총 폴리페놀 함량이 높은 것으로 나타났다. Lee 등의 연구(Lee et al., 2012)에서 환삼덩굴 메탄올 추출물의 총 폴리페놀 함량은 30.13 mg/g GAE로 나타났으며, 이는 8월에 채취한 환삼덩굴 추출물과 비슷한 수치이다.
Result are means ±S.D. of triplicate data.
전자공여능 측정에 사용된 2,2-diphenyl-1-picrylhydrazyl (DPPH)은 안정된 free radical이다. 환원되지 않은 상태에서는 자줏빛을 띠며 517 nm에서 최대 흡광도를 나타내고 황이 포함된 아미노산이나 ascorbic acid, butylated hydroxyanisole (BHA) 등 항산화제에 의해 환원되어 노란색을 띠게 된다. free radical은 인체 내에서 지질이나 단백질 등을 산화시켜 노화를 촉진하는데, 기존에 알려진 항산화 물질 및 페놀성 화합물은 free radical에 전자를 제공하여 소거 또는 중화시키므로 노화를 억제하는 데 도움을 준다(An et al., 2004; Yu et al., 2006). 이러한 DPPH의 특성을 이용하여 환삼덩굴 추출물의 전자공여능을 측정하였다.
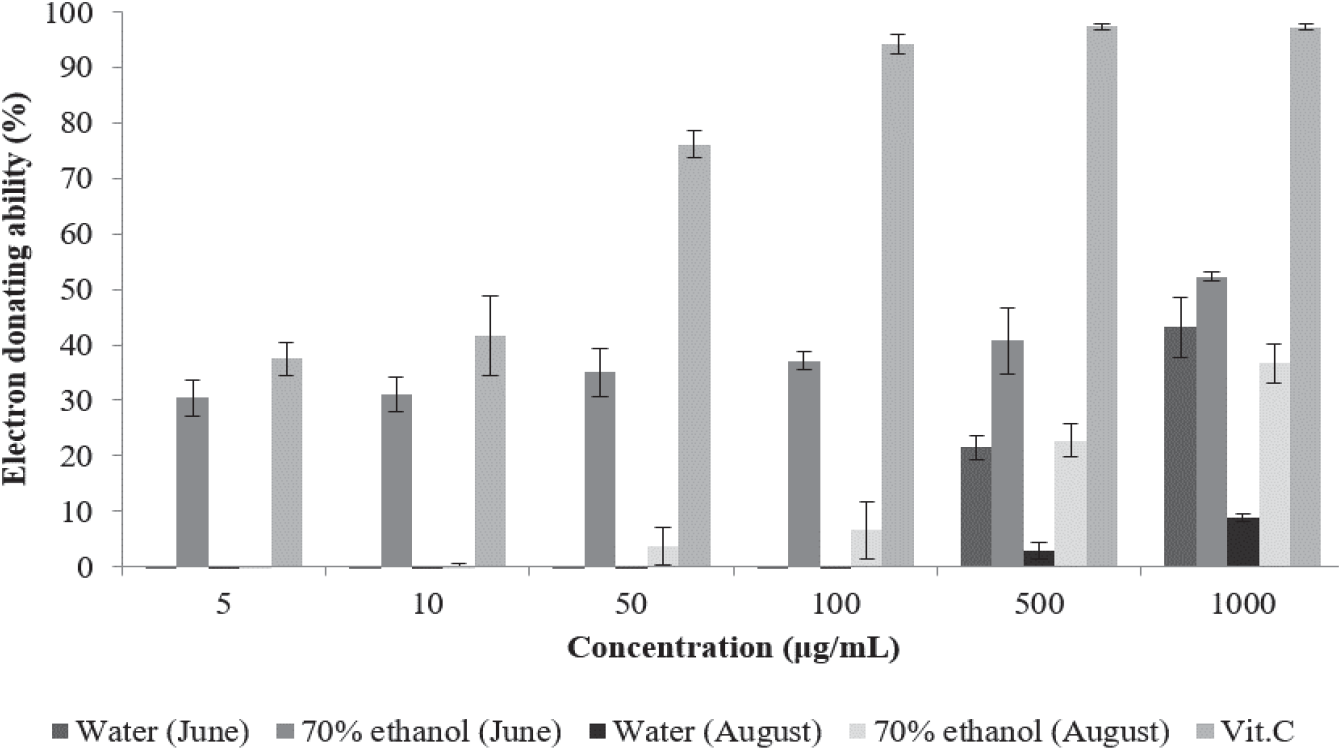
환삼덩굴 추출물의 전자공여능을 측정한 결과는 Figure 1과 같다. 6월에 채취한 환삼덩굴 70% 에탄올 추출물은 5 µg/mL에서 30.42%, 1,000 µg/mL에서 52.32%의 전자공여능을 나타내었으며, 8월 채취 70% 에탄올 추출물은 50 µg/mL에서 3.71%, 1,000 µg/mL에서 36.65%의 전자공여능을 나타내었다. 6월 채취 열수 추출물은 500 µg/mL에서 21.49%, 1,000 µg/mL에서 43.19%의 전자공여능을 나타내었으며, 8월 채취 열수 추출물은 500 µg/mL에서 2.89%, 1,000 µg/mL에서 8.91%의 전자공여능을 나타내었다. 채취 시기 및 추출 용매에 따른 전자공여능을 비교하면 같은 용매로 추출하였을 때 6월 채취 추출물이 8월 채취 추출물보다 전자공여능이 높게 나타났으며, 같은 시기에 채취한 추출물의 경우 70% 에탄올 추출물이 열수 추출물보다 전자공여능이 높게 나타났다. Lee et al.(2012)은 환삼덩굴 메탄올 추출물의 전자공여능이 1,000 µg/mL에서 38.87%로 나타났다고 보고한 바 있는데 이는 환삼덩굴 에탄올 추출물과 비슷한 활성이다.
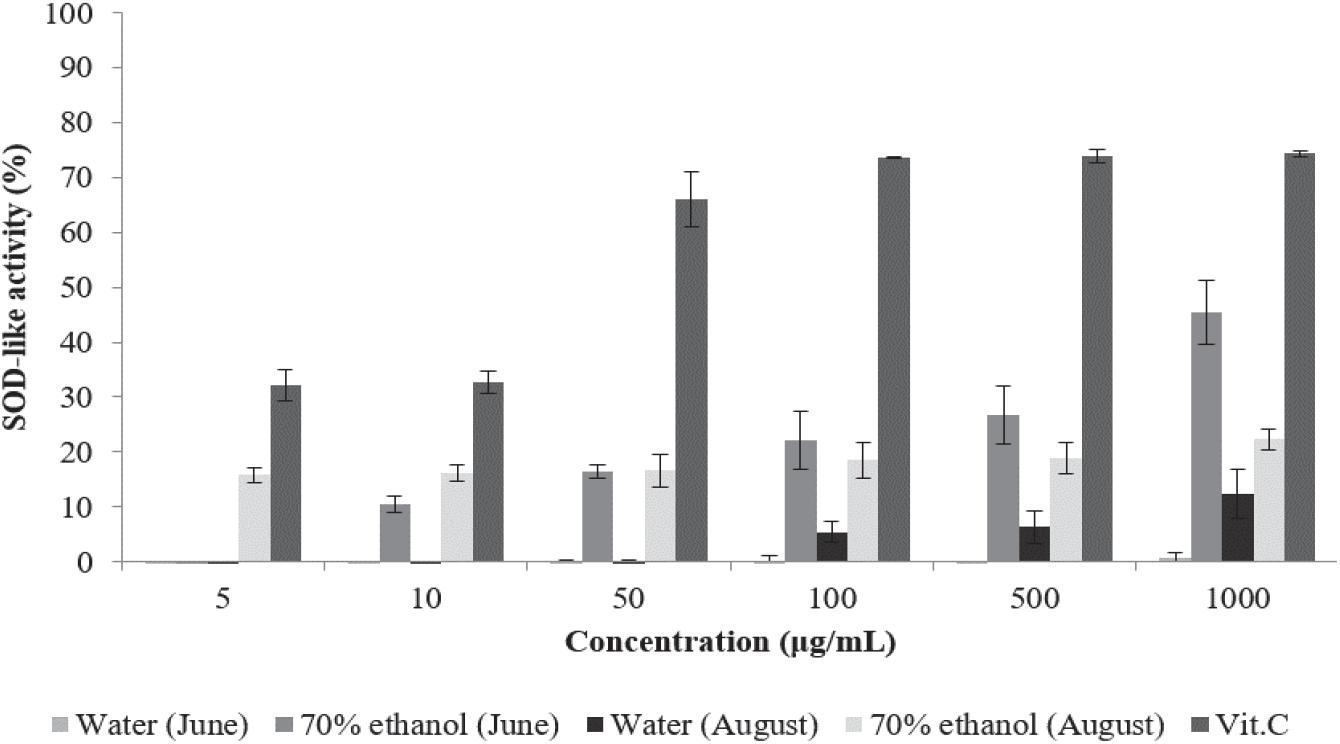
Superoxide dismutase (SOD)는 생체 내에서 활성산소를 제거하는 데 관여하는 효소 중 하나이며 superoxide (O2-)를 과산화수소(H2O2)로 만드는 효소이다(Alscher and Hess, 1993; Last et al., 1997). 천연물 중에는 SOD가 함유되어 있지 않으나 SOD와 유사한 활성을 나타내는 경우가 존재하며 이를 SOD 유사활성이라고 한다(Kitani et al., 2002). SOD 유사활성을 측정하는 데 사용하는 pyrogallol은 염기성 용액 (pH 7.9 ~ pH 10.6)에서 자동산화되며 이 자동산화는 SOD에 의하여 억제되는 반면 과산화수소를 물과 산소로 분해하는 catalase에는 영향을 받지 않는 것으로 알려져 있다(Marklund and Marklund, 1974).
이러한 원리에 따라 환삼덩굴 추출물의 SOD 유사활성을 측정한 결과는 Figure 2와 같다. 6월 채취 환삼덩굴 70% 에탄올 추출물은 10 µg/mL에서 10.45%, 100 µg/mL에서 22.19%, 1,000 µg/mL에서 45.45%의 활성을 나타내었으며, 8월 채취 에탄올 추출물의 활성은 5 µg/mL에서 15.81%, 100 µg/mL에서 18.52%, 1,000 µg/mL에서 22.3%로 나타났다. 8월 채취 열수 추출물은 100 µg/mL에서 5.45%, 1,000 µg/mL에서 12.38%의 활성을 나타내었다. 반면 6월 채취 열수 추출물은 최고농도인 1,000 µg/mL에서 0.62%의 미미한 활성을 나타내 superoxide 제거에 의한 항산화 활성을 거의 나타내지 않았다. 모든 시료에서 농도에 따른 활성 증가는 미미하였으며 열수 추출물보다는 에탄올 추출물이 활성이 높게 나타났다. Lee의 연구에서 금은화, 백선피, 연교 진공 열수 추출물이 1,000 µg/mL에서 각각 18.77%, 4.38%, 23.05%의 활성을 나타내었다고 보고한 것(Lee, 2020)과 비교하였을 때 6월에 채취한 환삼덩굴 추출물은 연교 추출물의 2배 정도의 활성을 나타내어 항산화제로써의 가능성을 나타내었다.
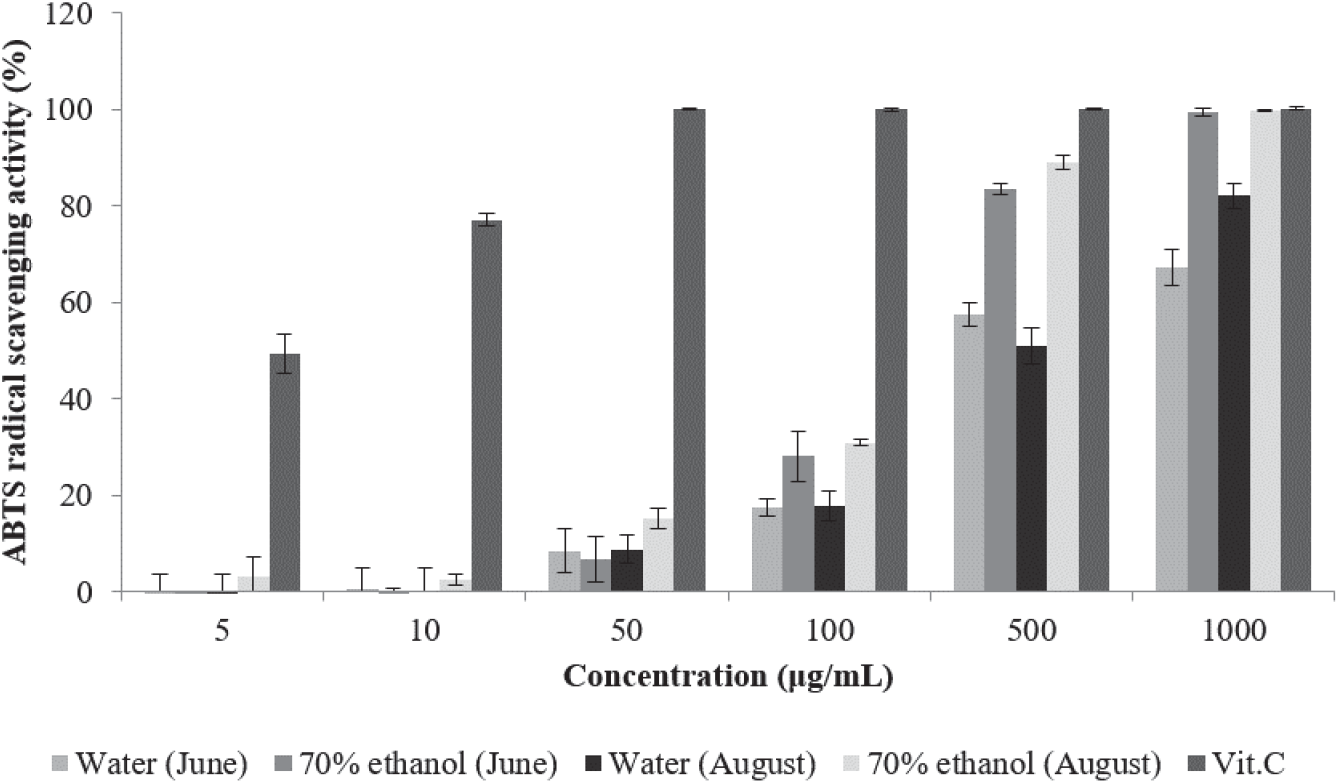
항산화 활성의 측정을 위하여 DPPH radical을 이용한 전자공여능 측정과 함께 일반적으로 사용되는 ABTS+ radical 소거능 측정 시험은 2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonnium salt (ABTS)와 potassium persulfate와의 반응으로 생성된 ABTS+ radical이 항산화 물질에 의해 환원되어 특유의 색인 청록색이 탈색되어 연한 녹색을 띠는 것을 이용한 방법이다(Kim et al., 2009).
환삼덩굴 추출물의 ABTS+ radical 소거능 측정 결과는 Figure 3과 같다. 6월에 채취한 환삼덩굴 70% 에탄올 추출 물은 50 µg/mL에서 6.63%, 1,000 µg/mL에서 99.42%의 소거능을 나타내었으며, 8월 채취 70% 에탄올 추출물은 5 µg/mL에서 3.09%, 1,000 µg/mL에서 99.74%의 소거능을 나타내었다. 6월 채취 열수 추출물은 10 µg/mL에서 0.68%, 1,000 µg/mL에서 67.16%의 소거능을 나타내었으며, 8월 채취 열수 추출물은 10 µg/mL에서 0.21%, 1,000 µg/mL에서 82.1%의 소거능을 나타내었다. 채취 시기 및 추출 용매에 따른 ABTS+ radical 소거능을 비교하면 같은 용매로 추출하였을 때 8월 채취 추출물이 6월 채취 추출물에 비해 높은 소거능을 나타내었으며, 채취 시기가 같은 경우 70% 에탄올 추출물이 열수 추출물보다 소거능이 높게 나타났다. 비트루트의 에탄올 추출물의 소거능이 1,000 µg/mL에서 59.5%, 고삼 열수 추출물이 91.6%로 보고된 것(Jung, 2020)과 비교하면 환삼덩굴 에탄올 추출물의 소거능은 비교적 높은 것으로 나타났다.
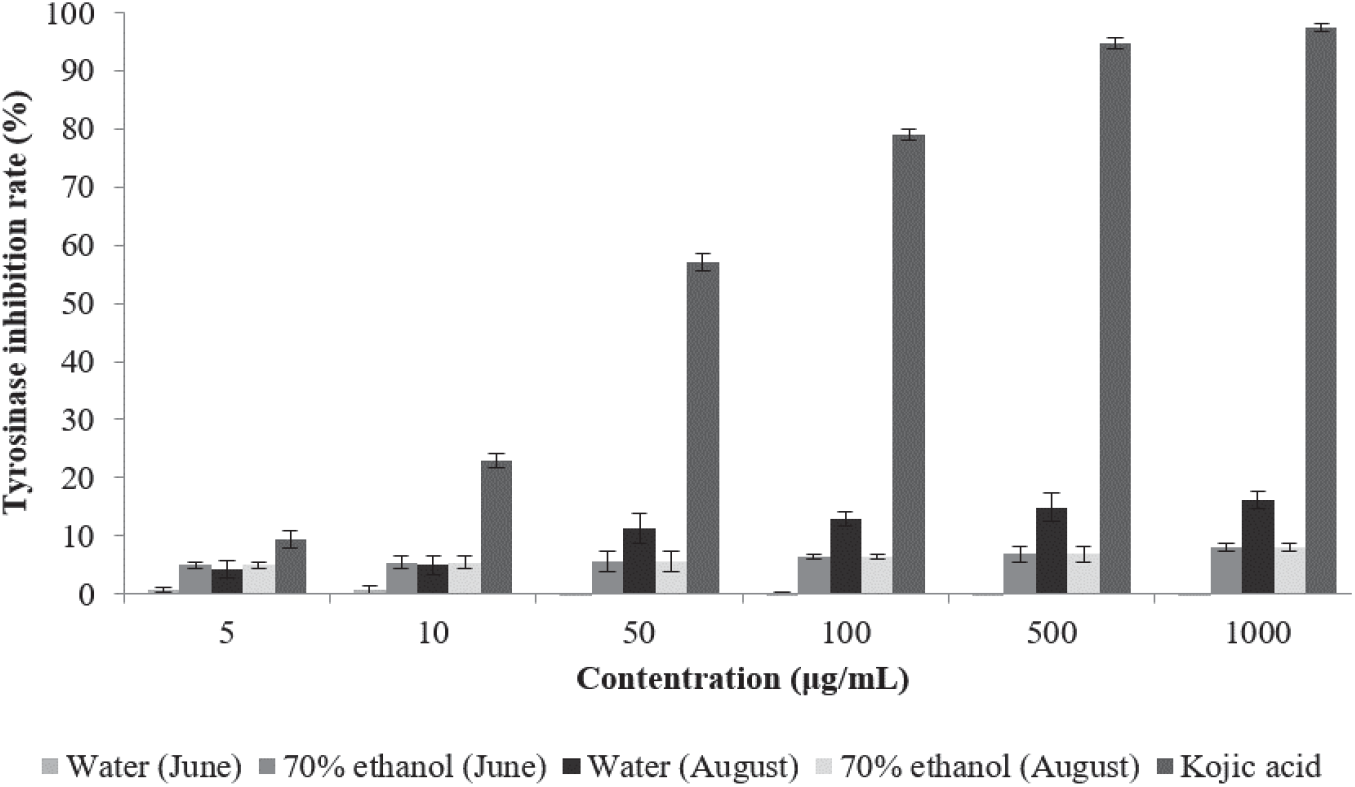
Tyrosinase는 melanin 생성 과정에서 가장 중요한 역할을 하는 효소로 아미노산의 일종인 tyrosin을 산화시켜 melanin 생성 전구체인 DOPA-quinone을 생성한다. Melanin의 생성량은 tyrosinase에 의하여 생성되는 DOPA-quinone의 양에 비례하므로 tyrosinase 활성 저해 실험은 피부 미백제 개발에 있어 유용한 평가법이라고 할 수 있다(Slominiski et al., 1988; Cha et al., 2010).
환삼덩굴 추출물의 tyrosinase 저해활성 측정 결과는 Figure 4와 같다. 6월에 채취한 환삼덩굴 70% 에탄올 추출물 은 5 µg/mL에서 4.97%, 1,000 µg/mL에서 8.07%의 활성을 나타내었으며, 8월 추출물은 5 µg/mL에서 7.2%, 1,000 µg/mL에서 14.7%로 나타났다. 6월 채취 환삼덩굴 열수 추출물은 저농도에서는 2.81%의 미약한 활성을 나타내었으나 고농도에서는 활성을 나타내지 않았다. 8월 채취 열수 추출물은 5 µg/mL에서 4.21%, 1,000 µg/mL에서 16.18%로 나타났다. 다만 Yang 등의 연구에서 당을 제거한 추출물과 ethyl acetate 분획물의 tyrosinase 저해활성이 일반 구아바 잎 추출물보다 매우 증가하는 것으로 나타난 만큼 tyrosinase 저해활성이 나타난 추출물의 경우 이후 가공 여하에 따라 미백 기능성 원료로서의 가능성이 있을 것으로 판단된다(Yang et al., 2008).
Elastin은 collagen과 같이 세포 외 기질(extracellular matrix)을 형성하는 주요 단백질이며 진피 내 피부 탄력을 유지하는 데 중요한 역할을 한다. Elastase는 elastin과 collagen을 분해하는 비특이적 가수분해 효소이며, 따라서 elastase의 활성을 저해함으로써 피부 주름 생성을 억제할 수 있다(Lee et al., 1999; Tsuji et al., 2001; Lee et al., 2003).
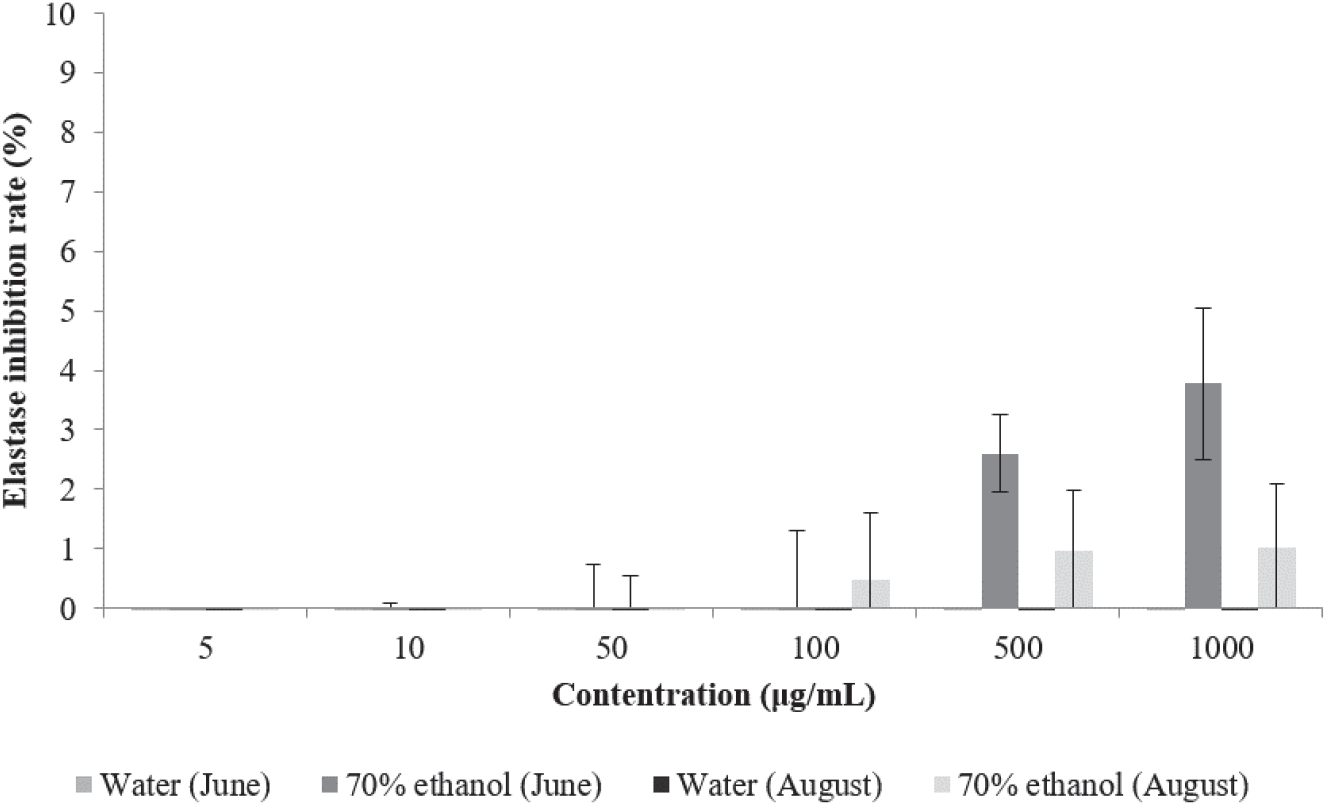
환삼덩굴 추출물의 elastase 저해활성 측정 결과는 Figure 5와 같다. 환삼덩굴 70% 에탄올 추출물은 최고농도인 1,000 µg/mL에서 6월에 채취한 시료 추출물이 3.77%, 8월에 채취한 시료 추출물이 1.03%의 저해활성을 나타내었으며 고농도로 갈수록 미미하게 저해활성이 증가하였으나, 열수 추출물은 추출 시기와 관계없이 활성을 나타내지 않았다. Lee 등이 남원・지리산권의 자원식물 10종의 elastase 저해활성을 측정한 결과 연꽃의 활성이 대조구인 ursolic acid와 비슷한 51%로 나타났으며 감국을 제외한 나머지 식물은 5~30%의 저해활성을 나타낸다고 보고하였는데 추출물의 총 폴리페놀 및 플라보노이드의 함량이 높을수록 elastase 활성 저해 능력 또한 높게 나타나는 경향을 보였으나 elastase의 활성을 증가시킨 감국이나 찔레꽃에 비해 낮은 총 폴리페놀 및 플라보노이드의 함량을 나타내었으나 elastase 저해활성이 더 높았던 연꽃같이 총 폴리페놀 및 플라보노이드의 함량과 elastase 활성 저해 능력이 다른 경향을 나타내는 예도 있었다(Lee et al., 2020).
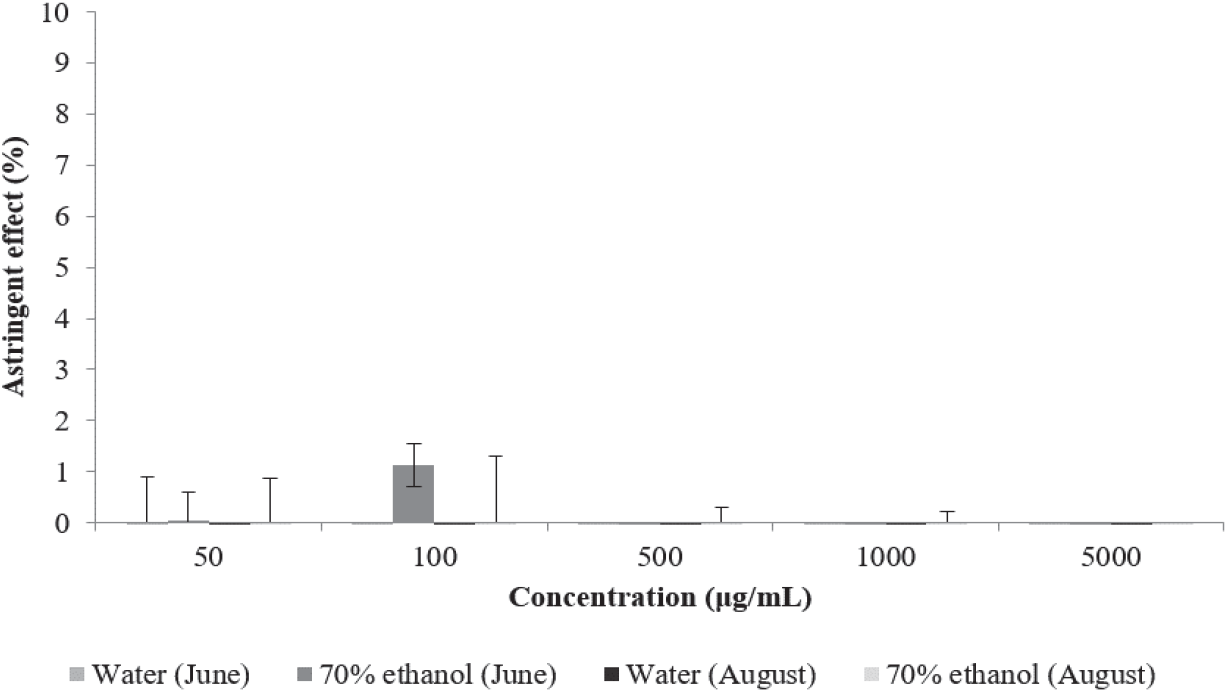
피부 단백질이 폴리페놀, 플라보노이드 등의 phenolic compound와 가교결합을 형성하여 피부가 수축하는 현상을 수렴작용이라고 한다(Okuda, 1986). 본 연구에서는 Lee 등이 사용한 피부 단백질과 유사한 색소단백질인 hemoglobin이 시료와 결합하는 정도를 측정하는 방법을 인용하여 수렴 효과를 판단하였다(Lee et al., 2002).
환삼덩굴 추출물의 피부수렴활성을 측정한 결과는 Figure 6과 같다. 6월에 채취한 환삼덩굴 70% 에탄올 추출물만 100 µg/mL에서 1.12%의 미약한 수렴활성을 나타내었으며 다른 추출물에서는 수렴활성이 나타나지 않았다.
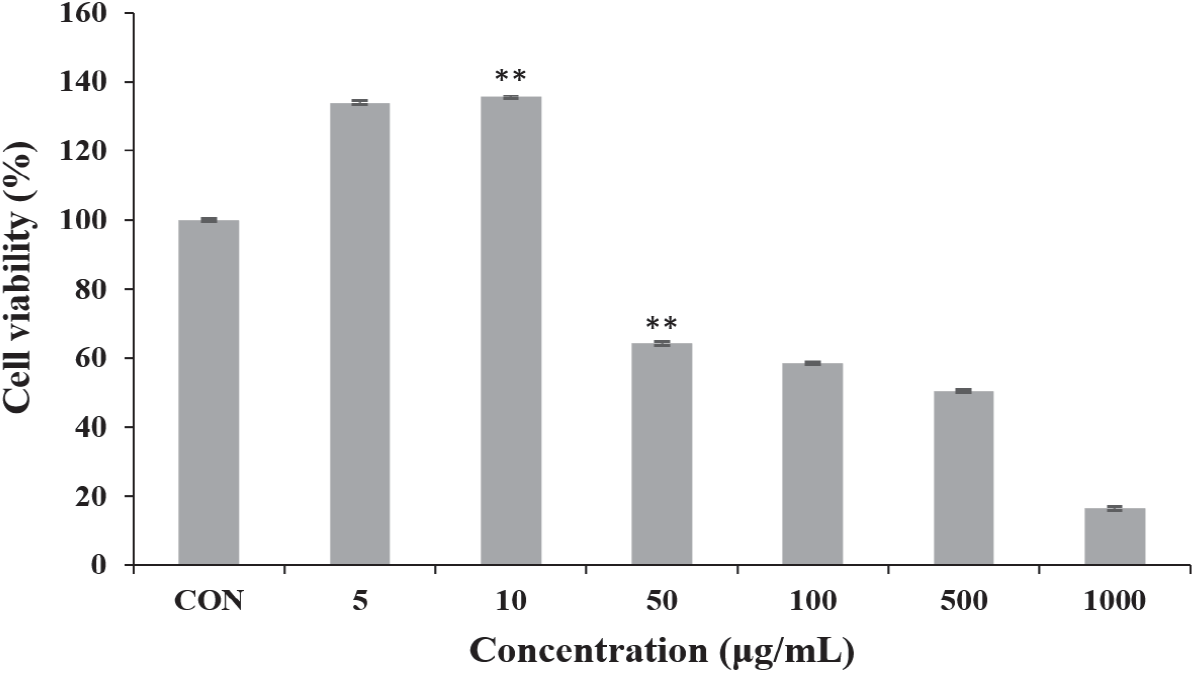
MTT assay로 총 폴리페놀 함량과 항산화 활성이 가장 높게 나타난 6월 채취 환삼덩굴 에탄올 추출물의 세포독성을 측정하였다. 그 결과 저농도인 5~10 µg/mL에서는 세포 증식효과를 나타내었으나 50 µg/mL에서 64.13%의 세포 생존율을 보여 강한 세포독성을 나타내었다(Figure 7).
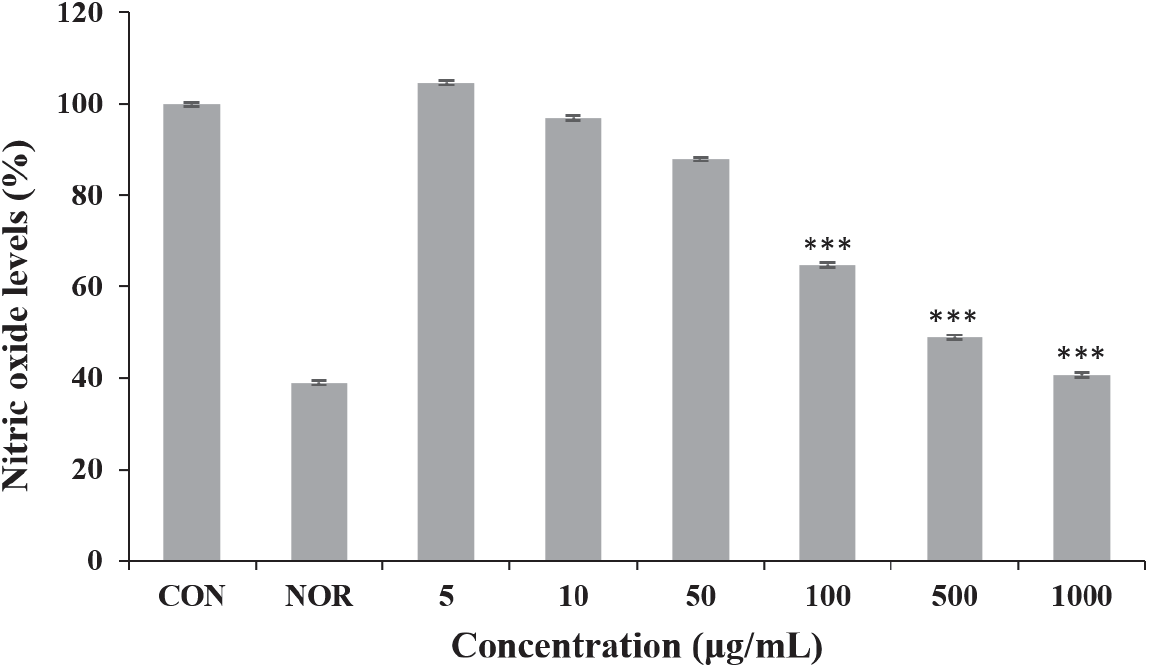
6월 채취 환삼덩굴 에탄올 추출물의 항염증 활성을 측정하기 위하여 raw 264.7 세포에 추출물을 농도별로 처리하여 NO 생성 억제능력을 확인하였다. 그 결과 추출물의 농도가 증가함에 따라 raw 264.7의 NO 생성이 억제되어 1,000 µg/mL에서의 NO 생성량이 40.7%까지 감소하였다(Figure 8). 다만 환삼덩굴 추출물은 고농도에서 세포 독성이 강하게 나타나 이 같은 결과가 세포사멸로 인하여 NO 생성이 감소한 것인지 추출물에 NO 생성억제 능력이 있는 것인지 불분명하므로 추후 연구가 필요한 부분이다.
결 론
환삼덩굴의 효율적인 이용을 위하여 개화 전인 6월과 개화 후인 8월의 환삼덩굴 지상부를 채취 후 천연물 시료 추출에 널리 사용되는 열수 및 에탄올로 각각 추출하여 항산화 활성과 효소 저해 활성을 비교하였다. 채취 시기 및 추출 용매에 따른 환삼덩굴 추출물의 총 폴리페놀 함량을 측정한 결과 6월에 채취한 환삼덩굴의 열수 추출물의 총 폴리페놀 함량은 41.09 mg/g GAE, 같은 시기에 채취한 70% 에탄올 추출물은 56.64 mg/g GAE를 나타내었으며, 8월에 채취하여 추출한 열수 추출물은 31.56 mg/g GAE, 에탄올 추출물은 31.81 mg/g GAE의 함량을 나타내어, 열수와 에탄올 추출물 모두 6월에 채취하여 추출한 것이 총 폴리페놀 함량이 높게 나타났으며, 채취 시기가 같은 경우 열수 추출물보다 70% 에탄올 추출물의 총 폴리페놀 함량이 높은 것으로 나타났다. 전자공여능, SOD 유사활성, ABTS radical 소거능 측정을 통하여 환삼덩굴 추출물의 항산화 활성을 측정한 결과, 총 폴리페놀 함량이 가장 높게 나타난 6월 채취 70% 에탄올 추출물의 활성이 모든 실험결과에서 가장 높았다. 8월에 채취한 시료 추출물의 총 폴리페놀 함량은 열수 추출물과 에탄올 추출물이 비슷하게 나타났다. 그러나 전자공여능, SOD 유사활성, ABTS radical 소거능 측정 모두 에탄올 추출물의 활성이 높게 나타나 항산화에 관여하는 물질은 70% 에탄올로 추출하였을 때 더 많이 추출된다고 판단되었다. 미백활성 평가를 위한 tyrosinase 저해활성 측정 실험에서 6월에 채취한 환삼덩굴 열수 추출물은 활성을 나타내지 않았으며 8월에 채취한 환삼덩굴 열수 추출물은 최고농도에서의 활성이 16.18%로 나타났다. 에탄올 추출물의 경우 최고농도의 활성이 6월 채취 추출물은 8.07%, 8월 추출물이 14.7%로 나타나 미백활성을 나타내는 성분은 6월보다는 8월에 함량이 높은 것으로 판단되었다. 피부 주름 생성 방지 활성 평가를 위한 elastase 저해활성의 경우 에탄올 추출물의 경우 매우 미미한 활성이 나타났으며 열수 추출물은 활성을 나타내지 않았다. 또한 모든 추출물에서 수렴활성이 나타나지 않아 환삼덩굴을 주름 생성 방지를 위한 기능성 원료로 사용하는 것은 적절하지 않다고 판단된다. 총 폴리페놀 함량과 항산화 활성이 가장 높게 나타난 6월 채취 환삼덩굴 에탄올 추출물의 세포독성(MTT assay)을 측정한 결과, 저농도인 5~10 µg/mL에서는 세포 증식효과를 나타내었으나 50 µg/mL에서 64.13%의 세포 생존율을 보여 강한 세포독성을 나타내었다. NO 생성 억제 능력의 경우, 농도가 증가함에 따라 Raw 264.7의 NO 생성이 억제되어 1,000 µg/mL에서의 NO 생성량이 40.7%까지 감소하였다. 그러나 이러한 결과가 세포 독성에 의한 것인지, 추출물의 효능에 의한 것인지는 추가 연구가 필요한 부분이다.






