서 론
복령(Wolfiporia hoelen (Fr.) Y.C.Dai & V. Papp; W. extensa; Poria cocos)은 버섯류에 속하는 진균류의 일종으로 분류학상 구멍장이버섯과(Polyporaceae) 복령속(Wolfporia)에 속하며, 소나무류(Piunus spp.) 절단목 뿌리에 부정형의 균핵을 형성하는 기생균이다(Choi et al., 2016; Kim and Kang, 2023). 자연계에서 일반 버섯과 동일한 생활 주기를 거치며, 세포 증식이나 생식 과정은 균사가 증식하여 균핵 또는 자실체를 형성하는 일반 담자균과 유사하다(Kim et al., 2002). 복령의 균사는 형태적으로 격막이 없는 섬유상 세포이며, 균핵 내부 색에 따라 백복령과 적복령으로 구분한다(Hong and Lee, 1990; Jo et al., 2013). 복령은 중국 고대 의학 지침서인 “Shennong Bencao Jing”에 가장 상급의 약재로 기록되어 있으며, 일반 버섯들과 달리 균핵을 여러 약초와 함께 사용하여 다양한 증상을 치료한다(Jia et al., 2016; An et al., 2020; Xu et al., 2022). 복령은 이뇨, 비장 강화, 부종, 만성 위염, 급성 위장염, 구토, 어지러움, 불면증 및 고지혈증 치료에 효과가 있으며, 아시아 및 유럽의 많은 나라에서 약용 및 식용으로 사용하고 있다(Hoang et al., 2005; Zhao et al., 2012; Jia et al., 2016; Li et al., 2019). 최근 연구에 의하면 복령으로부터 166 종류의 화학성분이 분리 및 동정 되었으며(Lu et al., 2021), 복령의 균사체에서 분리한 U-pachymaran, pachymaran, carboxymethlypachymaran의 항암 효과에 관한 연구와(Hamuro et al., 1971; Kim et al., 2012), polysaccharide에서 분리한 (1,3)-(1,6)-β-D-glucan의 항종양성 관한 연구도 수행되었다(Kanayama et al., 1983). 이처럼 복령의 주요 활성 성분은 polysaccharide, triterpenoids, fatty acid, sterol, enzyme 등으로 in vitro와 in vivo의 연구를 통해 항암, 항염, 항균, 항산화, 항우울증에 관한 활성 및 골형성 세포 분화에 영향을 주는 다양한 약리 활성이 밝혀지고 있다(Lee et al., 2018; Lu et al., 2021). 특히 복령의 주요 물질 중 하나인 triterpenoid는 비고리형 30탄소 전구체를 포함하는 천연화합물로 분류되며, 그 중 lanostane triterpenoid인 pachymic acid는 복령의 대표적인 화학 기능성 성분으로 산지에 따른 편차가 적어 복령의 지표성분의 기준이 될 수 있다(Tai et al., 1995; Hoang et al., 2005; Fu et al., 2018).
골다공증은 골흡수가 증가되어 발생하는 대사성 골질환으로 뼈 강도를 약화시켜 골절의 위험성을 증가시키며 나이가 들수록 발생빈도가 높아진다(Seo et al., 2020b). 현재 노령인구의 증가로 골다공증에 대한 관심이 증가되고 있으며, 치료비용에 대한 경제적 부담이 요구되고 있다(Goltzman, 2002; Cheon et al., 2012). 뼈는 동적인 조직으로 뼈를 지속적으로 흡수하는 파골세포와 새로운 뼈를 형성하는 조골세포의 균형을 이루면서 칼슘과 인을 이용한 무기질화 과정이 발생함으로써 항상성이 유지되며(Lee et al., 2016), 이러한 균형이 깨지는 경우 골다공증이 발생하게 된다(Rodan and Martin, 2000). 그러나 골다공증의 치료는 발병원인이 파골세포의 활성 증가인지, 조골세포의 활성 감소인지 명확하게 밝혀져 있지 않음에도 불구하고 주로 골흡수를 억제하는 방법을 사용한다(Pertyński and Stachowiak, 2006; Kim et al., 2019b). Bisphosphonate는 파골세포의 기능을 조절하여 골흡수를 줄이는 골다공증 일차 치료 약제로 매우 효과적이며 가장 많이 사용되고 있으나(Rodan and Martin, 2000; Jung et al., 2012; Chung et al., 2021), 위장관 장애, 악골 괴사 등의 부작용이 보고되고 있다(Khosla et al., 2007; Son et al., 2008). 따라서 기존 치료제를 대체할 수 있는 새로운 치료제를 개발하기 위한 필요성이 제기됨에 따라 독성효과를 최소화 하여 부작용이 적고, 약물의 흡수 및 생체 이용률이 높은 천연물에 대한 관심이 증가하고 있다(Kang et al., 2009; Lee et al., 2020). 천연물 중 골다공증 치료제 후보 물질은 두충, 오미자, 향심 등이 있으며(Seo et al., 2020b), 복령 추출물 역시 파골세포 분화 억제 효과를 나타내어 골질환 치료제 후보 물질로서의 가능성을 나타냈다(Cheon et al., 2012). 다만, 복령 종류와 재배 방법 등에 따라 파골세포 분화 억제 기전이 다르게 나타나기 때문에 골다공증에 대한 활성 효과를 확인하기 위해서 유효지표성분을 분리할 필요가 있다(Cheon et al., 2012; Kim et al., 2012).
따라서 본 연구의 목적은 복령 균핵 에탄올 추출물의 용매별 분획물의 유효성분을 분리 및 동정하여 지표물질을 확인하고 골대사 세포에 처리하여 골질환 예방 및 천연 치료제의 소재로써 활용 가능성을 알아보고자 수행하였다.
재료 및 방법
본 연구에 사용된 복령 균핵은 2019년 10월 국립산림과학원 어천시험림(37°16’09”N, 126°55’32”E) 노지에 10반복으로 매립하여, 2021년 10월 수확하여 동결 건조 후 분쇄하였다. 복령 재배지의 2019~2021년 10월까지 재배환경은 수원에 위치한 관측소(37°25’74”N, 126.98’3”E)를 기준으로 평균온도 13.7°C, 평균상대습도 72.7%, 월 평균강수량 103.5 mm, 평균지면온도 14.7°C로 나타났다(Korea Meteorological Administration, 2023).
재배한 복령 균핵 분말 30 kg을 10 kg씩 나누어 실온에서 50% 에탄올(EtOH)에 침적하여 72시간 동안 침출 후 3회 반복 추출하였다. 그 다음 추출액을 여과한 후, 여액을 회전 감압 농축기로 농축하여 추출물을 얻었다. 이렇게 얻어진 추출물을 증류수에 현탁하여, n-헥산(n-hexane), 디클로로메탄(CH2Cl2)및 에틸아세테이트(EtOAc) 순서에 따라 순차적으로 분석하였다. 복령 균핵 추출 및 주요 성분 분리에 사용한 에탄올, n-헥산, 디클로로메탄 및 에틸아세테이트는 대정화금(Korea) 제품을 사용하였다.
골대사 활성에 우수한 효과를 나타냈던 디클로로메탄 분획물(250.0 mg)을 preparative high-performance liquid chromatography system(prep-HPLC, Waters, MA, USA)를 이용하여 활성물질을 분리하였다(Table 1).
분리한 화합물들의 화학구조를 분석하기 위해 nuclear magnetic resonance(NMR, ADVANCE 500, Bruker, Germany)와 용매 Pyridine-d5(99.5%, Cambridge lsotope Laboratories, Inc., MA, USA)를 이용하여 분석하였으며, 1H- 및 13C- NMR(Pyridine-d5, 500 MHz), 2D-NMR(1H-1H COSY, DEPT, HMQC, HMBC)데이터를 수집하였다. 단일 화합물의 질량분석은 JMS 700(JEOL, Tokyo, Japan) 을 이용한 fast atom bombardment(FAB) 분석과 Q-TOP Xevo-G2 XS(Waters, Milford, USA)을 이용한 atmospheric solids analysis probe(ASAP) 방법으로 분석하였다(McEwen, 2010).
본 연구에 사용된 조골세포는 중간엽 줄기세포(mesenchymal stem cell)의 전구 세포인 C2C12 세포를 이용하였으며, C2C12 세포를 10% fetal bovine serum(FBS; Gibco BRL), 100 U/mL penicillin과 100 mg/mL streptomycin이 포함된 alpha-minimum essential medium(α-MEM) 배지에 37°C, 5% CO2의 환경조건으로 배양하였다. 조골세포 분화를 유도하기 위해 96 well-plate에 2.5×103/well이 되도록 세포를 배양한 후, 5% FBS, 100 ng/mL recombinant human bone morphogenetic protein-2(rhBMP-2)를 첨가하여 3일 동안 세포 분화 후 실험에 사용하였다.
ALP 효소 활성 검사는 p-nitrophenyl phosphate(p-NPP)의 가수분해 반응에 ALP가 촉매로 작용하는 원리를 이용하여, 가수분해 산물인 p-nitrophenol의 양을 측정함으로써 ALP 활성을 확인하는 방법으로 나타냈다(Meyer-Sabellek et al., 1988). 분화된 C2C12 세포를 phosphate-buffered saline (PBS)로 세척하여 10% 포르말린(Formalin)으로 5분간 고정 후 PBS로 세척하였다. ALP kit(Sigma-Aldrich Co, Mo, USA)에 제시된 프로토콜에 따라서 one-step p-NPP substrate solution(Thermo, IL, USA)으로 측정하여 나타냈다.
골수 유래 대식세포(Bone marrow macrophages, BMMs)를 α-MEM 배지에 10% FBS, 100 U/mL penicillin과 100 mg/mL streptomycin을 포함하여 5% CO2, 37°C 조건으로 배양 하였다. 파골세포 분화유도를 위해 96-well plate에 macrophage-colony-stimulating factor(M-CSF)가 10 ng/mL 함유된 배지에 24시간 동안 배양한 후, 1×104/well 농도로 분주하여 M-CSF 50 ng/mL와 receptor activator of nuclear factor-κB ligand(RANKL)를 30 ng/mL 첨가하여 4일 동안 배양하였다.
분화된 세포는 배지 제거 후 PBS로 세척하여 10% 포르말린으로 고정하고, 0.1% Triton X-100으로 10분간 세척하여 투과화하였다. TRAP buffer(100 mM sodium citrate, pH 5.0, 50 mM sodium tartrate)에 3 mM p-NPP를 포함하여 37°C에서 5분간 반응하였다. 반응한 용액은 새로운 플레이트에 옮기고, 같은 양의 0.1N 수산화나트륨(NaOH)으로 반응을 정지시킨 후 405 nm 파장에서 광학 밀도를 측정하였다.
세포의 생존율은 제공된 프로토콜에 따라 cell counting kit-8(CCK 8, Dojindo molecular technologies, MD, USA)를 사용하여 평가하였다. C2C12 세포와 BMMs 세포는 96-well plate에 각각 2.5×103/well,1×104/well 농도로 분주하여 24시간 배양한 후, 복령 분획물을 농도별(1, 3, 10, 30, 100 μM)로 처리하여 5% CO2 조건의 배양기에서 3일 동안 배양하였다. 이후 CCK-8 용액을 세포 배양액에 10 μL/well을 첨가하고 1시간 동안 37°C 배양기에서 반응하여 마이크로플레이트 스펙트로미터(SpectraMax M5, Molecular Devices, San Jose, USA)를 이용하여 405 nm 파장에서 흡광도를 측정하였다.
결과 및 고찰
건조된 복령 균핵 50% 에탄올 추출물 125.84 g을 증류수에 희석하여 n-헥산, 디클로로메탄, 에틸아세테이트 순으로 극성 차이에 따라 분획하였으며, 추출된 시료의 건중량을 건조된 복령 균핵의 건중량으로 나누어 백분율로 계산하였다. 그 결과, 수율은 에틸아세테이트(28.46%), 디클로로메탄(12.1%), n-헥산(11.1%) 순으로 나타났으나, Lee et al.(2018)이 복령 균핵 에탄올 추출물을 n-헥산, 디클로로메탄, 에틸아세테이트, 부탄올(n-BuOH)로 분획 하였을 때, n-헥산에서 높은 수율을 보인 것과는 차이를 보였다. 이는 천연 추출물은 천연물이 자란 환경이나 지역에 따라 달라질 수 있으며, 특히 버섯류인 복령의 경우 토양과 재배법에 따라 성분이 달라질 수 있다(Choi et al., 2016; Kim et al., 2016). 또한 추출 용매의 종류, 농도와 방법 등에 따라서도 효과가 다르게 나타난다고 하였다(Oh, 2019).
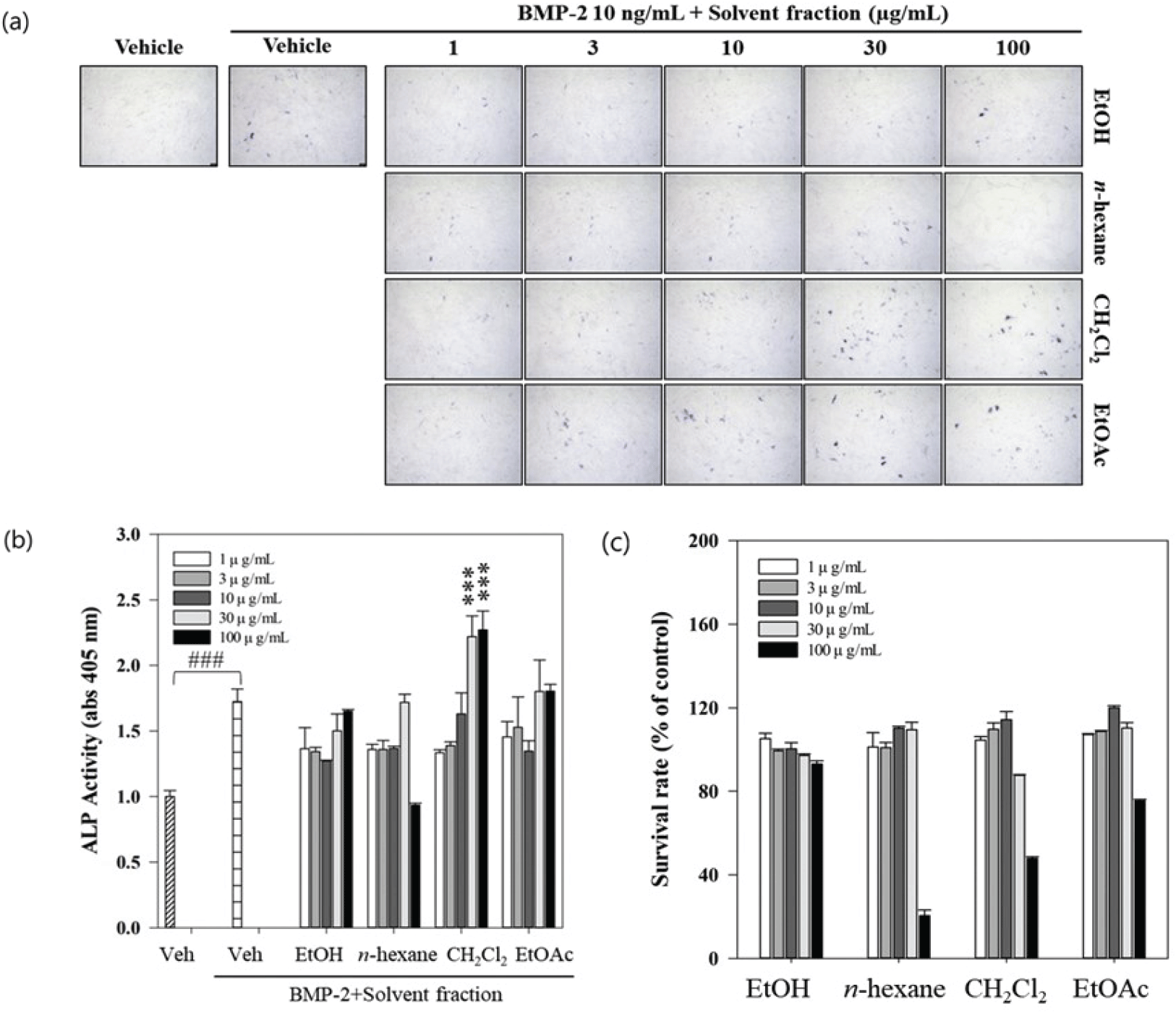
ALP는 조골세포의 분화활성을 나타내는 표지인자로 모든 조직에 분포하며, 특히 골 성장이 활발하게 일어날 때 활성이 증가한다(Boskey, 1989; Shim et al., 2009; Baek et al., 2018). Bone morphogenetic protein(BMP)-2는 전조골세포과 미분화된 줄기세포를 조골세포로 분화시키는 강력한 골 형성 유도제로, BMP-2를 처리한 조골세포는 강한 ALP 활성을 보이는 것으로 알려져 있다(Ryoo, 2001; Kim et al., 2021). 복령 균핵 분획물의 골대사 기능성분을 추적하기 위하여 농도별(1, 3, 10, 30, 100 μg/mL)로 C2C12 세포에 대한 ALP 활성을 평가하였으며, ALP 염색법을 이용하여 세포 분화를 육안으로 관찰할 수 있었다[Figure 1(a)]. 에탄올, n-헥산, 디클로로메탄, 에틸아세테이트 분획물 중에서 디클로로메탄 30 μg/mL와 100 μg/mL농도에서 ALP 활성이 각각 221.90%, 226.95%로 최대 활성을 나타냈으며, BMP-2 대조구보다 약 29%(p<0.001) 이상 유의미하게 증가하였다[Figure 1(b)]. 이전에 보고된 천연물 추출물에 따른 ALP 활성을 살펴보면 산양삼 추출물은 50 μg/mL에서, 가시오가피 추출물은 15 μg/mL 농도에서 ALP 활성이 높게 나타났다(Lim et al., 2007; Seo et al., 2020a). 홍국 색소 추출물은 100 μg/mL 농도일 때 124% 활성을 나타냈으며, 대조구보다 30% 높은 활성을 보였다(Kim et al., 2020). 벼의 도정과정에서 생기는 분쇄 혼합물인 미강을 원료로 한 추출물의 에틸아세테이트 분획물 100 μg/mL 농도에서 C2C12세포의 ALP 활성이 가장 높게 나타났으며(Moon et al., 2014), 톳 추출물은 부탄올 분획물에서 대조구보다 ALP 활성이 120% 정도 증가하였다(Jeon and Kim, 2011). 또한 표고버섯 품종인 향심의 주정과 물 추출물은 골 형성 정도를 반영하는 오스테오칼신(osteocalcin)에 영향을 주어 골다골증을 개선 및 예방 할 수 있으며(Lee et al., 2020), 복령을 주 원료로 하는 한약재는 조골세포의 Wnt/β-catenin 신호전달 경로를 통해 난소 절제술로 인한 골다공증을 완화하고 골 손실을 예방 할 수 있다고 하였다(Xia et al., 2014; Zhang et al., 2016; Song et al., 2018). 본 연구에서 ALP 활성 농도는 용매에 따라 약간의 차이가 있으나 30-100 μg/mL의 범위에서 증가하는 경향을 보였으며, 이러한 결과는 조골세포 분화를 촉진하는데 있어 영향을 주는 것으로 판단된다. 조골세포의 효과 검증을 이용한 소재 개발을 위하여 최우선으로 독성평가를 진행하여 활용이 가능한 농도 범위를 필수적으로 설정하여야 한다(Sim and Ji, 2021). 이러한 근거를 바탕으로 각 분획물의 세포독성 확인 결과 100 μg/mL농도에서 4개의 분획 전부 세포 생존율이 감소하였으며, 용매에 따라 약 11.5%에서 79.8%까지 감소하였다[Figure 1(c)]. 본 연구와 유사한 연구를 살펴보면 복령 에탄올 추출물은 100 μg/mL 농도 이상에서 세포가 유의적으로 감소하였고, 복령피의 에탄올 추출물도 50 μg/mL에서 급격하게 생존율이 감소하는 경향을 보였다(Oh, 2019; Kim et al., 2019b). 또한 복령 균핵의 메탄올 추출물은 25 μg/mL에서 강한 세포독성을 가진다고 보고하였다(Li et al., 2004). 종합적으로 복령 균핵의 에탄올 추출물의 농도는 30-100 μg/mL 이내의 범위로 설정하는 것이 적당할 것으로 생각된다.
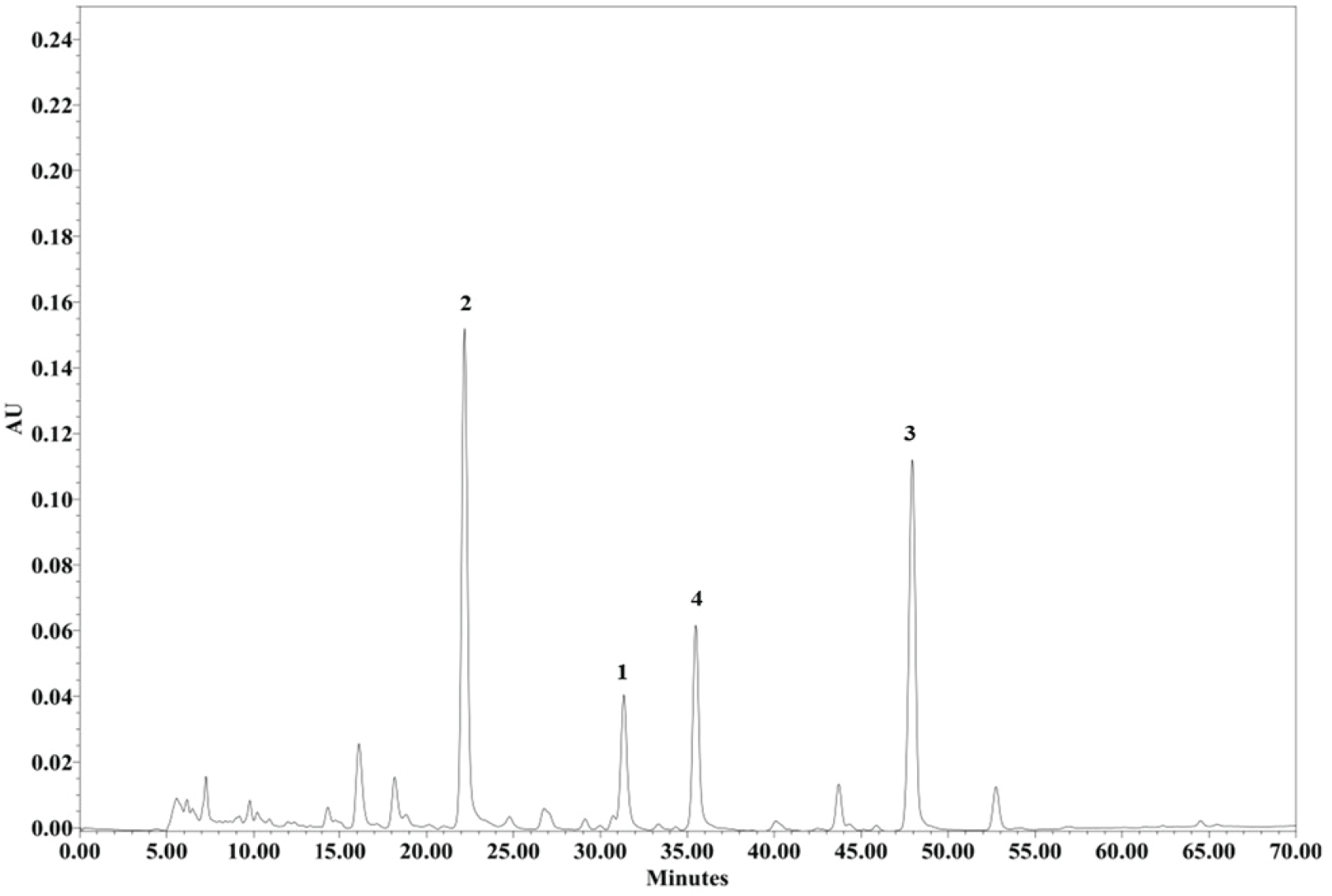
디클로로메탄 분획물에서 Prep-HPLC를 이용하여 백색분말의 형태 즉, 화합물 1(RT: 32분, 14.4 mg), 화합물 2(RT: 24분, 12.5 mg), 화합물 3(RT: 48분, 51.5 mg) 그리고 화합물 4(RT: 35분, 10.3 mg)로 분리 및 동정하였다(Figure 2).
화합물 1의 FAB Mass의 주요 이온 peak는 m/z 437.3452 [M+H]+, m/z 454.3474, m/z 455.3552 (base ion) 및 m/z 456.3563 등이 나타났다.
1H-NMR (500 MHz, pyridine-d5) δ : 1.02 (3H, s, H-18), 1.07 (3H, s, H-30), 1.08 (3H, s, H-19), 1.14 (3H, s, H-29), 1.23 (3H, s, H-28), 1.28 (1H, dd, J = 5.0, 10.0 Hz, H-5), 1.46 ~ 1.56 (3H, m, H-23, H-1, H-15), 1.62 (3H, s, H-27), 1.68 (3H, s, H-26), 1.75 ~ 1.85 (2H, m, H-15, H-22), 1.88 ~ 2.02 (4H, m, H-2×2, H-1, H-22), 2.09 ~ 2.24 (3H, m, H-6×2, H-23), 2.25 ~ 2.23 (1H, m, H-16), 2.35 ~ 2.44 (2H, m, H-12, H-16), 2.49 ~ 2.59 (2H, m, H-12, H-17), 2.65 ~ 2.70 (1H, m, H-20), 3.45 (1H, t, J = 7.5, 15.0 Hz, H-3), 5.34 (1H, d, J = 5.0, H-24), 5.38 (1H, d, J = 5.0, H-11), 5.63 (1H, d, J = 5.0, H-7). 13C-NMR (125MHz, pyridine-d5): Table 2.
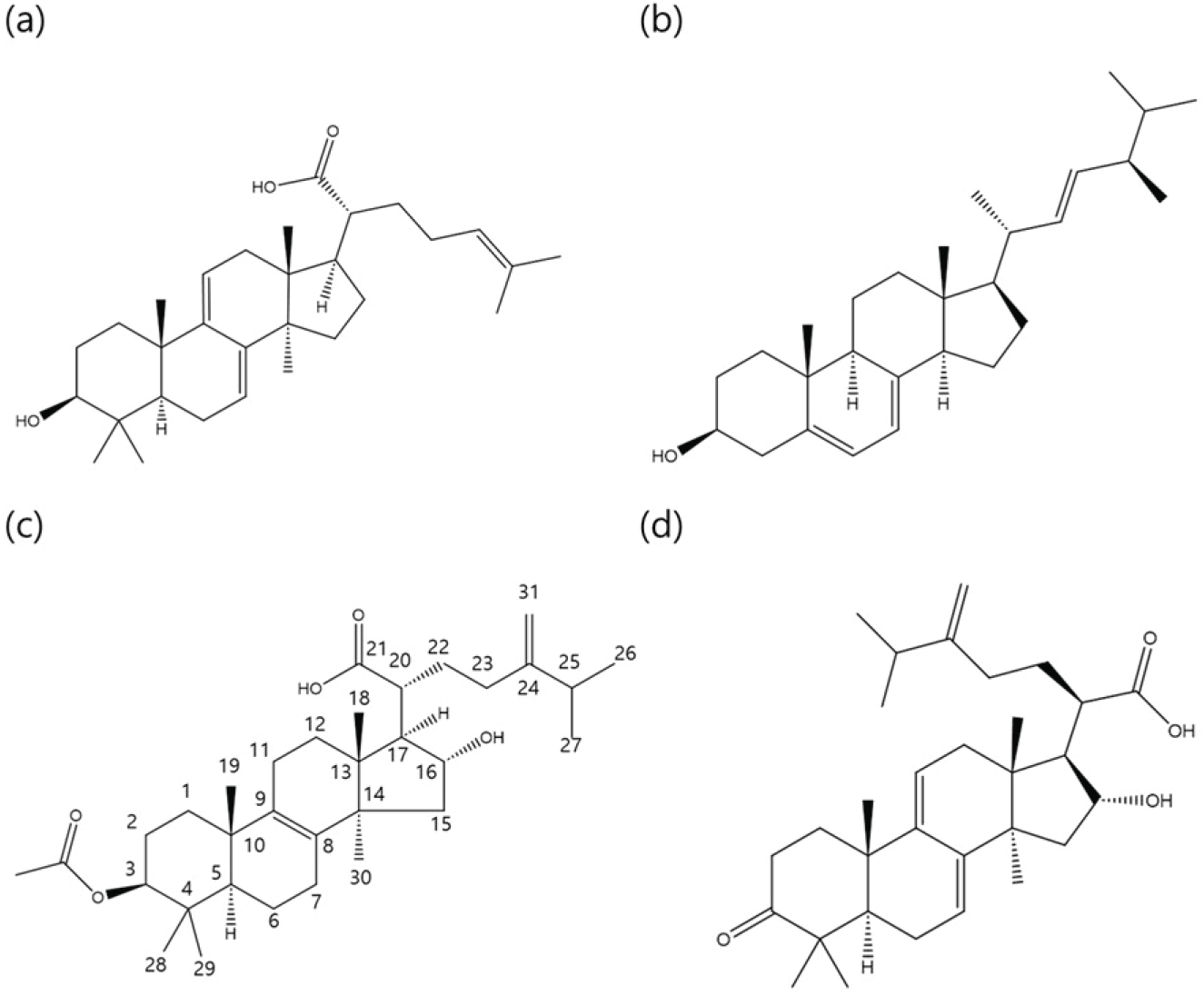
LC/Mass의 ESI 스펙트럼에서 분자이온 peak가 m/z 453.3 [M-H]+를 나타내어, 화합물 1의 분자량이 m/z 454.3 [M]+임을 알 수 있었다. 화합물 1의 1H-NMR 스펙트럼의 고자장 영역대에 나타난 δ 1.02 (3H, H-18), δ 1.07 (3H, H-30), δ 1.08 (3H, H-19), 1.14 (3H, H-29), δ 1.23 (3H, H-28), δ 1.62 (3H, H-27), δ 1.68 (3H, H-26)에서 나타난 21H에 상당하는 7개의 singlet 시그널은 methyl proton에 유래하는 것을 알 수 있었다. 화합물 1의 저자장측에 나타난 δ 5.34 (1H, d, J = 5.0, H-24), δ 5.38 (1H, d, J = 5.0, H-11), δ 5.63 (1H, d, J = 5.0, H-7)에서의 3H에 해당하는 3개의 doublet signal은 화합물 1의 구조 중에 olefinic proton에 기인하는 것으로 각각 H-24, H-11 및 H-7번 proton에 각각 귀속 하였다. 또한 화합물 1의 13C-NMR 스펙트럼에서는 31개의 탄소 peak를 나타냈으며, 이중 δ 16.02 (C-18), δ 16.38 (C-29), δ 17.48 (C-27), δ 22.72 (C-19), δ 25.53 (C-30), δ 25.61 (C-26) 및 δ 28.42 (C-28)에 나타난 7개의 peak는 화합물 1에 나타나는 methyl group의 탄소에 각각 귀속하였다. 그리고 저자장측에 나타난 δ 116.36 (C-11), 121.05 (C-7), 124.60 (C-24), 131.50 (C-25), 142.55 (C-8) 및 146.37 (C-9)의 6개의 탄소들은 화합물 1의 분자구조 중에 존재하는 olefinic 탄소에 기인한다. δ 178.27의 peak는 화합물 1의 구조중에 caboxyl group에 기인하는 것으로 C-21번 탄소에 귀속하였는데, 이는 화합물 1의 HMBC 스펙트럼에서 H-20번 proton과 C-21 탄소 peak의 교차 peak를 확인함으로써 caboxyl group이 C-20번 위치에 결합한 것을 나타냈다. 이상의 기기분석 데이터와 문헌(Yang et al., 2019)의 결과를 비교 분석하였을 때, 화합물 1은 복령에서 기 보고된 lanostane type의 triterpenoids 종류인 3α-dehydrotrametenolic acid로 동정하였다[Figure 3(a)].
화합물 2의 분자량은 FAB-Mass에서 m/z 397.3383 (base ion), m/z 396.3388 [M]+와 m/z 397.3429 [M+H]+를 나타냈다.
1H-NMR (500 MHz, Chloroform-d) δ: 0.63 (3H, s, H-18), 0.82 (3H, d, J = 7.0 Hz, H-26), 0.84 (3H, d, J = 7.0 Hz, H-27), 0.92 (3H, d, J = 6.8 Hz, H-28), 0.94 (3H, s, H-19), 1.03 (3H, d, J = 6.6 Hz, H-21), 1.25 ~ 1.40 (5H, m, H-1, 2, 11, 12, 17), 1.45 ~ 1.53 (2H, m, H-11, 25), 1.65 ~ 1.74 (1H, m, H-16), 1.85 ~ 1.90 (4H, m, H-1, 9, 20, 24), 1.95 ~ 2.10 (3H, m, H-9, 12, 20), 2.46 (1H, m, H-4), 3.64 (1H, m, H-3), 5.20 (2H, dd, J = 7.0, 11.0 Hz, H-22, 23), 5.38 (1H, d, J = 5.5 Hz, H-7), 5.57 (1H, d, J = 5.5 Hz, H-6). 13C-NMR (125MHz, pyridine-d5): Table 2.
화합물 2의 1H-NMR 분석결과 δ 0.63 (3H, s, H-18)과 δ 0.94 (3H, s, H-19)에서 6H에 상당하는 singlet은 angular methyl proton에 기인하는 것으로 나타났다. 또한 δ 0.84 (3H, d, J = 7.0 Hz, H-27), δ 0.82 (3H, m, H-26), δ 0.92 (3H, d, J = 6.8 Hz, H-28), δ 1.03 (3H, d, J = 6.6 Hz, H-21)의 시그널은 화합물 2의 methyl group에 유래하는 proton에 각각 귀속하였고, 이는 화합물 2의 DEPT 스펙트럼에서 확인하였다. 그리고 δ 5.20 (1H, m, H-22, H-23), δ 5.38 (1H, d, J = 5.5 Hz, H-7), δ 5.57 (1H, d, J = 5.5 Hz, H-6)에서의 시그널은 화합물 분자구조 중에 3개의 olefin proton에 존재를 나타냈다. 화합물 2의 13C-NMR에서는 총 28개의 탄소 시그널들이 나타났다. 저자장 측에 나타난 δ 116.29 (C-7), δ 119.59 (C-6), δ 131.98 (C-23), δ 135.57 (C-22), δ 139.79 (C-5) 및 δ 141.37 (C-8)에 해당하는 탄소 peak로부터 tetracyclic triterpen분자 구조 중에 3개의 이중결합의 존재를 확인 할 수 있었다. 또한 δ 70.47 (C-3)의 peak로부터 한 개의 hydroxyl group(-OH)이 결합하고 있는 것을 알 수 있었다. 이와 같은 특징을 바탕으로 문헌상의 데이터와 비교 분석한 결과(Ibrahim et al., 2022), 복령 성분 중 하나인 sterol 기본구조에 5,7-diene sterol 골격의 화합물인 ergosterol로 동정하였다[Figure 3(b)].
화합물 3의 분자량은 m/z 528.3812 [M]+으로 확인하였다.
1H-NMR (500 MHz, pyridine-d5) δ: 0.93 (3H, s, H-29), 0.94 (3H, s, H-28), 0.98 (3H, s, H-19), 1.00 (3H, d, J = 7.0 Hz, H-26), 1.01 (3H, d, J = 7.0 Hz, H-27), 1.01 (3H, s, H-28), 1.15 (3H, s, H-18), 1.18 (2H, br. s, H-1, H-5), 1.50 (3H, s, H-30), 1.53 (1H, m, H-6), 1.55 (1H, m, H-1), 1.61 (1H, m, H-2), 1.65 (1H, m, H-6), 1.71 (1H, m, H-2), 1.72 (1H, d, J = 13.0 Hz, H-15), 1.95 (2H, m, H-11), 2.01 (1H, m, H-12), 2.03 (3H, s, CH3CO-), 2.10 (2H, m, H-7), 2.21 (1H, m, H-12), 2.30 (1H, m, H-23), 2.40 (1H, m, H-25), 2.46 (1H, m, H-15), 2.56 (1H, m, H-23), 2.66 (1H, m, H-22), 2.84 (1H, dd, J = 5.0, 10.0 Hz, H-17), 2.96 (1H, dt, J = 5.0, 10.0 Hz, H-20), 4,54 (1H, t, J = 5.0, 10.0 Hz, H-16) 4,69 (1H, dd, J = 5.0, 10.0 Hz, H-3), 4,87 (1H, s, H-31), 5,00 (1H, s, H-31). 13C-NMR (125MHz, pyridine-d5): Table 2.
화합물 3의 1H-NMR 스펙트럼에서 δ 0.93 (3H, s, H-29), δ 0.94 (3H, s, H-28), δ 0.98 (3H, s, H-19), δ 1.15 (3H, s, H-18), δ 1.50 (3H, s, H-30)에서 각각 3H에 해당하는 singlet peak로부터 5개 angular methyl group의 존재를 확인할 수 있었다. 또한 δ 2.03 (3H, s, CH3CO-)의 시그널은 화합물 3에 존재하는 acetyloxy group의 proton에 유래한다. δ 4.54 (1H, t, J = 5.0, 10.0, H-16)와 δ 4.69 (1H, dd, J = 5.0, 10.0 Hz, H-3)에서의 proton은 H-16위의 methylene proton과 acetyloxy group이 결합하고 있는 H-3 위의 proton에 각각 귀속하였다. 또한 δ 4.87 (1H, s, H-31)과 δ 5.00 (1H, s, H-31)의 두 개의 singlet 시그널은 전형적인 triterpenoids 화합물 중에서 볼 수 있는 exomethlyene proton (=CH2)의 존재를 나타내고 있다. 화합물 3의 13C-NMR 스펙트럼에서는 총 33개의 탄소 시그널들을 확인할 수 있었으며, δ 107.4 (C-31), δ 134.8 (C-9), δ 135.4 (C-8), δ 156.5 (C-24)의 peak로부터 화합물 3의 분자구조 중에 2개의 double bond가 존재함을 확인할 수 있었다. 또한 δ 21.5 (CH3CO-), 및 δ 171.0 (CH3CO-)에서 존재하는 2개의 peak로부터 나타난 acetyloxy group의 carbonyl(CH3CO-)의 peak로 확인되었다. 이상의 기기분석 및 문헌(Ukiya et al. 2002; Zheng and Yang 2008) 검색을 통해 화합물 3은 복령의 주성분 중의 하나로 알려진 pachymic acid으로 동정하였다[Figure 3(c)].
화합물 4의 TOF Mass 스펙트럼에서 m/z 449.3423, m/z 467.3574 (base ion), m/z 468.3571 및 m/z 484.3548 등의 이온 peak들이 관측되었고, 이 중 분자이온은 m/z 484.3 [M]+으로 확인 하였다.
1H-NMR (500 MHz, pyridine-d5) δ: 1.00 (3H, d, J = 3.4 Hz, H-26), 1.01 (3H, d, J = 3.4 Hz, H-27), 1.09 (6H, s, H-18, H-19), 1.15 (3H, s, H-29), 1.23 (3H, s, H-28), 1.32 (1H, dd, J = 4.4, 11.1 Hz, H-5), 1.52 (4H, br. s, H-1, H-30), 1.92 ~ 2.02 (4H, s, H-1, H-2×2, H-15), 2.20 (2H, m, H-6), 2.30 (1H, m, H-25), 2.40 ~ 2.50 (4H, m, H-12, H-15, H-22, H-23), 2.56 (1H, m, H-23), 2.63 ~ 2.78 (2H, m, H-12, H-22), 2.91 (1H, m, H-17), 2.98 (1H, m, H-20), 3.47 (1H, t, J = 7.7, 15.4 Hz, H-3), 4.56 (1H, t, J = 6.9, 13.7 Hz, H-16), 4.86 (1H, s, H-31), 5.00 (1H, s, H-31), 5.41 (1H, d, J = 5.8 Hz, H-11), 5.65 (1H, d, J = 5.0 Hz, H-7). 13C-NMR (125MHz, pyridine-d5): Table 2.
화합물 4의 1H-NMR 스펙트럼의 고자장측에 나타난 δ 1.00 (3H, H-26), δ 1.01 (3H, H-27), δ 1.09 (6H, H-18, H-19), δ 1.52 (3H, H-30), δ 1.15 (3H, H-29) 및 δ 1.23 (3H, H-28)에 나타낸 27H에 상당하는 7개의 singlet 시그널은 methyl proton에 귀속하였다. 그리고 화합물 4의 1H-1HCOSY스펙트럼에서 H-16번 proton과 H-15번 proton 사이의 상관 peak, H-16과 H-17의 사이의 proton 상관 peak를 각각 확인하였다. 또한 HMBC 스펙트럼에서 C-16 시그널 탄소와 H-17번 proton 및 H-16번 proton 사이의 교차 peak를 각각 확인함으로써, 분자구조 중의 hydroxyl group이 C-16번에 결합한 것을 알 수 있었다. 이상의 기기분석 결과와 문헌 비교를 통하여(Song et al., 2002; Zhou et al., 2008), 화합물 4는 기 보고된 lanostane type의 tertracyclic triterpenoids의 하나인 dehydrotumulosic acid로 동정하였다[Figure 3(d)].
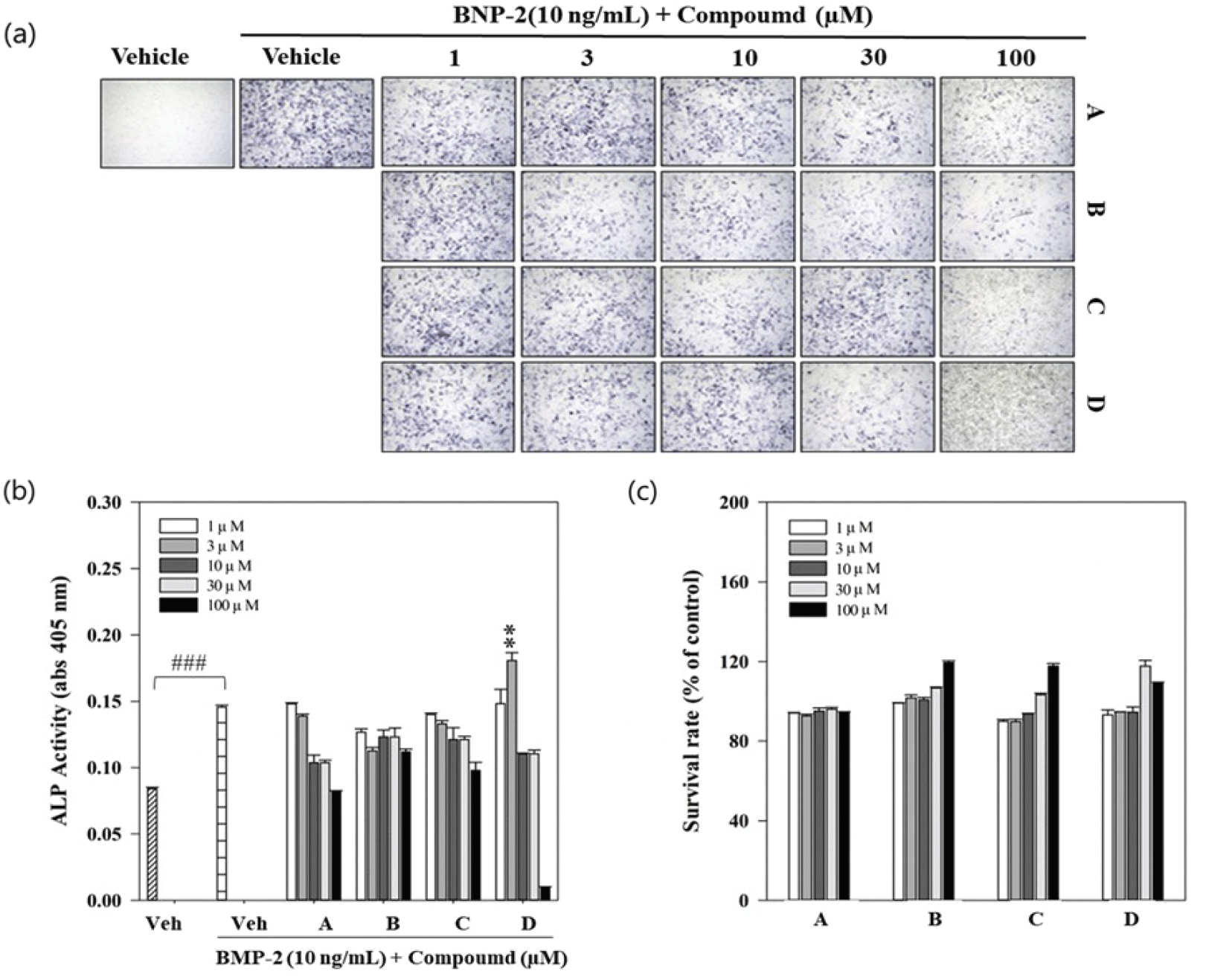
본 실험에서 분리 및 정제한 4개의 화합물을 BMP-2로 분화가 유도된 C2C12 세포에 농도별(1, 3, 10, 100 μM)로 처리하여 ALP 염색반응과 분화활성을 관찰하였다[Figure 4(a), 4(b)]. 분리된 화합물 중 dehydrotumulosic acid의 3 μM 농도에서 ALP 활성 160%로 BMP-2 대조구보다 약 24%(p<0.01) 유의미하게 증가하는 것을 관찰하였다. 화합물에 따른 세포 독성을 ALP 활성과 동일한 농도별로 검정한 결과 세포 생존율에 영향을 미치지 않는 것으로 나타났다[Figure 4(c)].
복령에서 분리 및 정제한 triterpenoids 분획물은 항균활성이 우수하며, 암세포의 성장 저해 활성이 높아 항암과 항염에 효능이 있다고 하였다(Nukaya et al., 1996; Kwon et al.,1999). Lee et al.(2018)는 에탄올 추출물에서 분리된 diterpene류는 골세포의 촉진을 보였으나, triterpene인 dehydroeburicoic acid monoacetate와 eburicoic acid acetate는 골성분화를 유도하는데 어떤 활성도 나타내지 않았다고 하였다. 반면, 본 연구에서 triterpenoid인 dehydrotumulosic acid에서 활성이 나타난 것을 확인할 수 있었으며, triterpenoid 계열이라도 물질에 따라 활성이 다르게 나타남을 추측할 수 있다. 지속된 염증은 골다공증과 같은 근골격계 질환의 발생기전에 관련되며, lipopolysaccharides (LPS)에 의해 생성된 TNF-α는 자가면역질환, 류마티스 관절염 등 주요 염증질환과 관련되어 있기 때문에 염증반응에 있어 중요한 역할을 하며(Kim et al., 2022), 다른 사이토카인의 생성을 유도함으로써 염증반응을 지속시키게 된다. Pachymic acid 와 dehydrotumulosic acid는 급성 및 만성염증 모델에서 항염증 화합물로 연구되었으며(Giner-Larza et al., 2002), 이러한 연구 근거를 바탕으로 본 연구 역시 세포 단계 실험에서 조골세포 분화에 긍정적인 효과를 나타내며 면역력 향상과 골다공증 치료제의 가능성을 보였다.
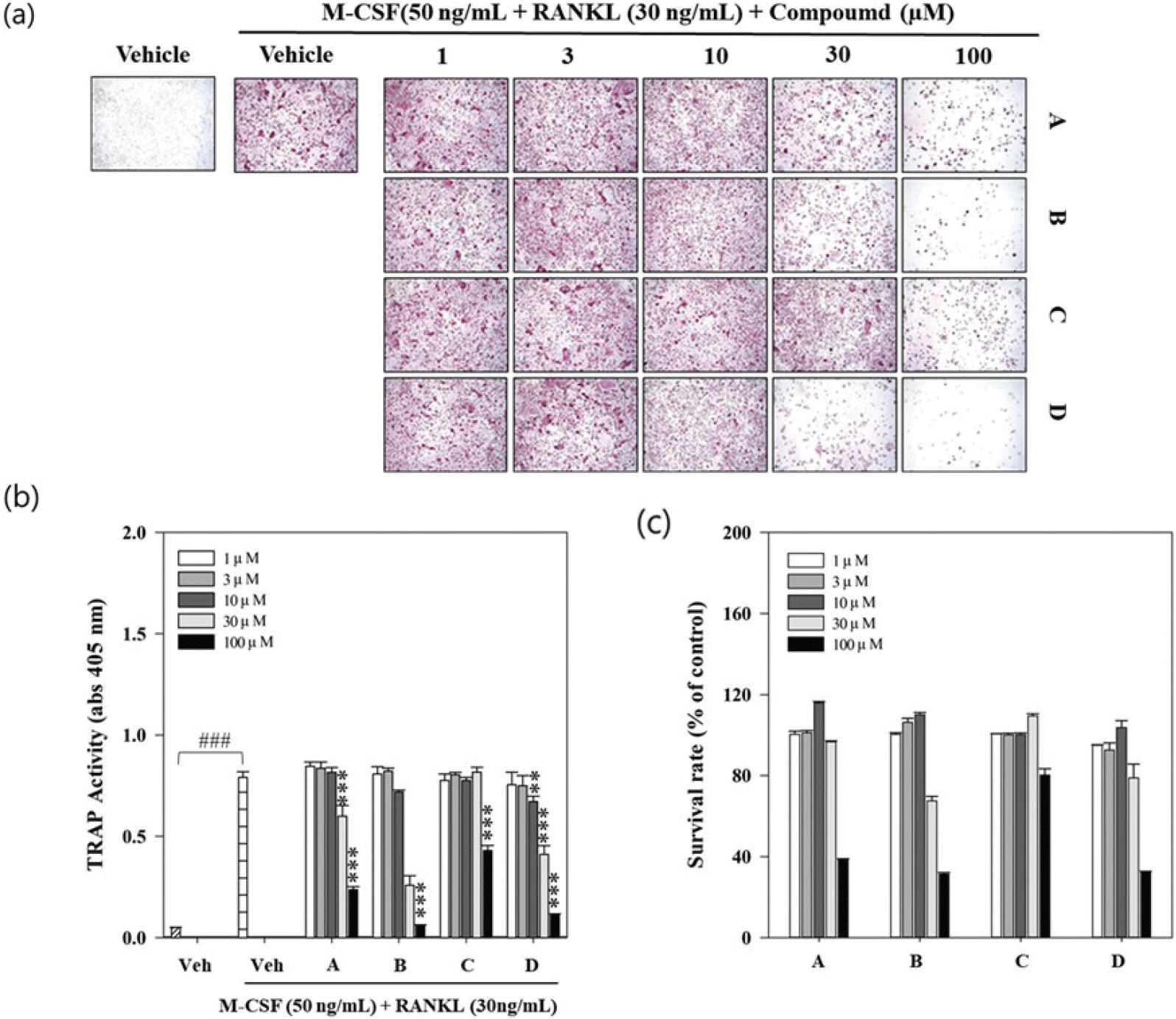
4개의 화합물과 RANKL로 자극한 대조군을 비교했을 때, 화합물 모두 100 μM에서 모두 TRAP 활성이 억제됨을 현미경을 통해서 관찰하였다[Figure 5(a)]. 특히 dehydrotumulosic acid에 의한 TRAP 활성은 RANKL 대조구보다 10-100 μM 에서 약 15-86%까지 유의미하게 감소한 것으로 나타났다[Figure 5(b)]. 이와 같은 결과가 세포독성에 의한 것인지 판단하기 위해 BMMs에 대한 세포독성을 검정한 결과 4개 화합물 모두 30 μM에서 세포 생존율이 감소하였다[Figure 5(c)]. 따라서 4개의 화합물의 농도 30 μM 에서 나타난 억제 활성은 세포독성으로 인한 것으로 간주되나, dehydrotumulosic acid의 10 μM 농도에서 나타난 억제 활성은 세포독성과 다른 패턴으로 나타나는 것을 알 수 있었다. 본 연구에서 확인한 바와 같이 BMMs 세포에 대하여 30 μM 이하의 농도에서 세포독성이 유발되지 않을 것으로 판단되며, dehydrotumulosic acid 화합물의 파골세포 분화 억제에 영향을 줄 수 있을 것으로 보인다. 섬애약쑥의 용매별 추출물은 20 μg/mL 농도까지 파골세포에 대한 세포독성이 유발되지 않았으며, TRAP 활성의 감소효과를 보고하였다(Kim et al., 2019a). 또한 Jang et al.(2012)은 큰느타리버섯과 만가닥버섯의 물 추출물에서 파골세포 분화 저해활성을 확인하였으며, 영지버섯에서 분리된 ganoderic acid에 의한 c-Fos 및 NFATc1의 발현억제는 골다공증 치료제의 가능성을 보여주는 결과라고 하였다(Miyamoto et al., 2009). 복령 추출물 역시 RANKL에 의해 진행되는 분화과정에 관여하는 NFATc1의 발현을 억제하고, 양성 TRAP 분화를 회복한다고 보고하였으며(Cheon et al., 2012), 복령의 클로로포름 분획물에서 분리된 몇 개의 성분들은 골모세포와 지방세포에 상호작용 효과가 있어 노인들의 골다공증 치료제로 가능성을 제시하였다(Lee et al., 2018). 복령에서 분리된 pachymic acid와 dehydrotumulosic acid는 인산지방 총분해효소 A2의 길항적 억제제인 특정 triterpenoids인 ganoderma와 schinus의 구조적으로 관련이 있으며, 인산지방 총 분해효소와 상호작용을 함으로써 염증을 억제할 수 있는 자연적 소재이며, 세포독성 또는 세포 사멸효과로 인해 항암제로서 큰 잠재력을 가지고 있다(Cuéllar et al., 1996; Rios et al., 2012). Hwang et al. (2020)에 의하면, 복령의 수용성 에탄올 추출물에서 파골세포 분화 억제에 효과가 있었으며, polyporenic acid, pachymic acid 와 polysaccharide 등의 화합물이 파골세포 흡수활성과 생성에 영향을 미친다고 하였다(Song et al., 2018). 이와 같은 결과들을 종합해 볼 때, 복령 균핵에서 분리한 dehydrotumulosic acid 역시 TRAP 활성 감소능을 가지는 것으로 나타나 파골생성을 억제하여 항골다공증 효과를 가질 것으로 예상된다.
결 론
본 연구는 골대사성 불균형에 의한 골밀도 감소를 초래하는 골다공증 개선제로서 복령 균핵 분획 추출물과 분획 추출물로부터 분리한 단리 물질의 가능성을 제시하고자 수행하였다. 복령 균핵 에탄올 추출물을 n-헥산, 디클로로메탄, 에틸아세테이트 순으로 분획을 실시하였다. 그 중 조골세포 증가에 효과를 나타냈던 디클로로메탄 층을 Prep-HPLC를 이용하여 4개의 화합물을 분리하였다. 분리 정제한 화합물은 Mass와 NMR을 이용하여 lanostane type의 tetracyclic triterpenoids인 3α-dehydrotrametenolic acid, pachymic acid, dehydrotumulosic acid와 sterol 구조의 ergosterol 화합물을 각각 구조 동정하였다. 구조 동정한 물질을 각각 조골세포와 파골세포 분화에 효과검증을 하였으며, 그 중 dehydrotumulosic acid의 첨가는 C2C12의 분화를 유도하고, BMMs 세포는 RANKL에 의한 분화 유도를 억제하는 효과가 있었다. 따라서 본 연구는 복령의 균핵에서 추출한 성분이 골모세포 분화를 증진시키거나 억제 할 수 있는 역할을 할 수 있으며, 복령의 디클로로메탄 분획물에서 분리 정제된 dehydrotumulosic acid가 골다공증 예방 및 치료에 도움을 줄 수 있을 것으로 판단하였다. 하지만 복령의 triterpenoids 중 dehydrotumulosic acid가 조골세포 미치는 영향과 그에 따른 메커니즘에 관한 국내연구는 미비한 실정으로 본 연구 결과를 활용하여 향후 복령의 triterpenoids 물질에 대한 조골세포 분화와 관련된 무기질 침착, 및 유전자와 단백질 발현 등의 메커니즘이 분석이 이뤄져야 할 것으로 판단된다.






