Article
목재의 나이테 생성 시기에 따른 DNA 추출 수율 및 PCR 성공률: 소나무(Pinus densiflora) 목재의 사례
김소현1,
이병주1,
안지영2,
이제완2,
이현미3,
어수형1,*
DNA Yield and PCR Success Rate of the Establishment Time of Wood Annual Ring: A Case Study of Korean Red Pine (Pinus densiflora)
So Hyeon Kim1,
Byeong-Ju Lee1,
Ji Young Ahn2,
Jei-Wan Lee2,
Hyun-Mi Lee3,
Soo Hyung Eo1,*
Author Information & Copyright ▼
1Department of Forest Science, Kongju National University, Yesan 32439, Korea
2Forest Bioresources, National Institute of Forest Science, Suwon 16631, Korea
3Division of Wood Engineering, National Institute of Forest Science, Seoul 02455, Korea
© Copyright 2023 Korean Society of Forest Science. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Jul 14, 2023; Revised: Dec 15, 2023; Accepted: Dec 15, 2023
Published Online: Dec 31, 2023
요 약
불법 목재 유통을 막기 위해 DNA를 활용한 수종 및 원산지 식별이 이루어지고 있지만, 목재의 물리·화학적 특성 때문에 양질의 DNA를 얻기 어렵다. 본 연구에서는 목재 DNA 추출 수율과 polymerase chain reaction (PCR) 성공률에 목재 조직의 나이가 영향을 미치는지 알아보기 위하여, 국내 주요 수종인 소나무 원목에서 DNA를 추출하여, 목재의 나이테 생성 시기와 추출 DNA 농도(ng/μl) 및 순도(A260/A280) 그리고 PCR 성공률(%)의 관계를 확인하였다. 분석 결과, 나이테가 형성층으로부터 멀어질수록, 즉 오래 전에 생성된 목재일수록, 추출한 DNA의 농도와 순도는 유의하게 감소하였다. 증폭 길이가 짧은 trnM-trnV(285 bp) 영역과 rpoC1(298 bp) 영역의 경우 PCR 증폭 성공률이 100 %였으나, rbcL(1.3 kb) 영역의 경우 66.67 %였고 30년보다 오래된 조직에서는 모두 증폭에 실패하였다. 시간이 지남에 따라 목재 세포의 사멸과 함께 양질의 DNA가 파괴되어 DNA 농도, 순도, PCR 성공률이 감소한 것으로 판단된다. 본 연구 결과는 향후 목재를 활용한 수종 동정 등에 유용하게 활용될 것으로 기대된다.
Abstract
To prevent illegal timber distribution, DNA markers have been used to identify the species and origin. However, extracting high-quality DNA from timber is difficult because of its physical and chemical properties. In this study, we investigated whether the age of timber tissue influences the yield of DNA extraction and the success rate of polymerase chain reaction (PCR) to understand the relationship between the establishment time of the wood annual ring and the extracted DNA concentration (ng/μl), purity (A260/A280), and PCR success rate (%) from pinewood, a major Korean domestic species. According to the results, it was observed that as the distance from the cambium increased, indicating that the tissue was older, the concentration and purity of the extracted DNA decreased significantly. For the trnM-trnV (285 bp) and rpoC1 (298 bp) regions, the PCR success rate was 100%. However, for the rbcL (1.3 kb) region, the PCR success rate was 66.67%. Moreover, PCR amplification of the rbcL region failed at all points older than 30 years. Thus, it is deduced that as time passes, along with the decay of timber cells, DNA is degraded, leading to a decrease in DNA concentration, purity, and PCR success rate. The results of this study are expected to be beneficial for future applications, such as the species identification of timber, providing valuable insights and potential utilization in this field.
Keywords: wood tissue; wood forensic analysis; chloroplast genome; DNA degradation; PCR amplification rate
서 론
불법 목재는 무분별한 벌채로 인해 생태계 파괴, 야생동물의 서식지 파괴, 대기 중의 탄소 흡수원 감소, 목재 시장가격 혼란 등 생태·경제적 문제를 일으킨다(Lee et al., 2014). 목재 수종 식별과 원산지 확인은 불법 목재의 유통 방지를 위해 필요하다. 수종 식별 방법으로 현미경을 이용한 목재 해부학적 분석이 주로 사용되었지만, 목재 해부학적 구조에 대한 전문 지식이 필요하며 유사 수종 간 식별에 어려움이 있다(Ohyama et al., 2001; Jiao et al., 2015). 이러한 문제에 대한 대안으로 목재 DNA 분석법이 사용되고 있다(Jiao et al., 2015; Lee et al., 2021).
목재 DNA 분석법은 DNA 다형성을 이용한 종 식별 방법이며(Deguilloux et al., 2002), 표준화된 유전자 영역을 통해 신속하고 정확한 종 식별이 가능하고, 비교적 쉽게 활용할 수 있다는 장점이 있다(Hebert and Gregory, 2005). 이러한 분자 유전학적 방법은 종 식별에서 원산지 확인 및 개별 원목 또는 목재 제품 추적에 이르기까지 다양한 수준에서 목재를 식별하는 데 사용될 수 있다(Lowe and Cross, 2011). 이 분석법을 활용하기 위해서는 고농도의 깨끗한 DNA를 필요로 한다. 그러나 목재는 목질화가 되어 파쇄가 어렵고, DNA 추출과 증폭 효율을 저해시키는 다당류, 단백질, 폴리페놀 등의 화학 물질을 포함하고 있다(Rachmayanti et al., 2009; Abdel-Latif and Osman, 2017). 따라서 목재 조직은 식물 DNA 추출에 주로 사용되는 잎에 비해 추출되는 DNA 양과 질이 좋지 않다(Tang et al., 2011; Fatima et al., 2018).
목재 DNA의 양과 질은 목재 부위에 따라 다르다. 목본식물에서는 형성층에 의해 새로운 목재 조직이 형성됨에 따라 기존 목재 조직은 점차 안으로 위치하게 되며 새롭게 생긴 조직이 상대적으로 바깥에 위치하게 된다. 또한, 목재 조직은 시간이 지남에 따라 세포의 활동력이 둔해지고 결국 사멸하기 때문에(Bamber, 1976), 세포 내 존재하였던 DNA 또한 분해된다(de Souza Borges et al., 2017). 따라서 형성층과 가까운 목재 조직일수록 살아있는 세포의 수가 많고, 세포 사멸 이후라도 DNA 분해 정도가 낮다.
본 연구의 목적은 목재 조직의 생성 후 경과 시간, 즉, 나이가 이 목재 부위로부터 추출한 DNA의 농도 및 순도, 그리고 이 DNA를 이용한 PCR의 성공률에 영향을 주는지 확인하는 것이다. 이를 위해 국내 주요 수종인 소나무(Pinus densiflora) 원목의 나이테 위치에 따른 DNA의 양과 순도 및 PCR 증폭 성공률(%)을 구명하고자 한다. 오래된 목재 조직일수록 온전한 DNA가 감소하고 PCR 방해 물질이 상대적으로 증가하여, 목재 DNA 농도 및 순도, PCR 증폭 성공률이 감소할 것으로 예상하였다.
재료 및 방법
1. 소나무 목재 나이테 위치에 따른 파쇄
실험에 사용된 소나무 목재는 2018년 10월 초에 벌채되었으며, 지름 약 30 cm, 두께 약 4 cm, 수령 48년의 소나무 원판을 사용하였다. 원판 표면의 이물질을 제거하기 위해 멸균된 사포를 이용하여 원판의 겉면을 약 4 mm 정도 갈아주었다. 그 다음 10 %의 차아염소산나트륨과 70 %의 에탄올을 사용하여 겉면을 소독한 다음 1차 증류수로 닦아주었다. 이후 수피에서 중심까지 나이테를 확인하며 5년 간격으로 총 8개의 지점을 선정하여, 10 % 차아염소산나트륨, 70 % 에탄올 용액, 1차 증류수로 소독한 드릴을 사용하여 목재를 파쇄하여 분말로 만들었다(Figure 1). 파쇄된 시료는 1.5 ml tube에 담아 이후 실험에 곧바로 사용하였다.
Figure 1.
The crushed points along annual rings on wood disk of Pinus densiflora. The Pinus densiflora wood disk(ø = 30 cm, thickness = 8 cm), the age of which is approximately 48 years, was cut in early October 2018.
Download Original Figure
2. 파쇄된 목재 시료로부터의 DNA 추출
각 지점 별 파쇄 시료를 3개의 1.5 ml tube에 20 mg으로 소분하여 총 24개의 시료를 준비하였다. 파쇄한 목재 시료로부터의 DNA 추출은 DNeasy plant mini kit(Qiagen)를 사용하였으며, 제조사의 매뉴얼을 따라 진행하였다. 추출된 목재 DNA의 농도(ng/μl)와 순도(A260/A280)는 UV-Vis(자외선-가시광선) 흡광도 원리로 작동하는 Nanodrop LITE spectrophotometer(Thermo scientific)을 사용하여 측정하였다. DNA 농도(ng/μl)의 경우, DNA 분자가 흡수하는 260 nm 파장의 흡광도를 통해 농도를 계산하며, 순도(A260/A280)의 경우 DNA의 260 nm 파장과 다양한 아미노산들이 흡수하는 280 nm 파장의 비율을 통해 계산된다(de Souza Borges et al., 2017). 측정에 앞서 DNA 균질화를 위해 5초간 중간 세기에서 vortexing 하였으며, 2회 측정 후 평균하였다.
3. PCR 증폭 실험
나이테 위치에 따른 DNA 상태를 PCR 성공 여부로 확인하기 위해, 24개 DNA 시료를 대상으로 chloroplast genome DNA의 trnM-trnV, rpoC1 partial 영역, rbcL parital 영역 총 3개의 영역을 1회씩 증폭하였다(Table 1). trnM-trnV와 rpoC1 partial 영역의 경우 소나무와 구주소나무를 식별하기 위해 제작한 primer set(Lee et al., 2017; Lee et al., 2018)을 이용하였으며, rbcL partial 영역의 증폭은 Petit et al. (1998)이 제시한 primer set를 이용하였다. 각 영역별 증폭 조건은 참고문헌(Table 1)을 기초로 하여 잎 DNA를 대상으로 최적의 조건을 찾은 후 목재 DNA에 적용하였다. 각 PCR 반응의 총 용량은 25 μl이며, DNA는 5 ng, Taq reaction buffer는 1X로, dNTP(each 10 mM)는 200 μM, primer는 각 0.2 μM, Taq polymerase (BioFACT A-Star Taq 5 U/μl)는 2.5 U가 되도록 첨가 후, ddH2O로 나머지 용량을 맞추었다. PCR은 목재 DNA 영역별 PCR 증폭 조건에 맞추어 실험하였다. PCR 증폭은 94°C에서 5분간 샘플을 반응시킨 후, 94 °C에서 1분, 각 프라이머 annealing 온도 54°C ~ 62°C에서 1분(rbcL partial 영역은 1분 30초), 72°C에서 1분을 1반복으로 총 39회를 반복하였으며, 마지막으로 72°C에서 8분 동안 반응시켰다. 이후 PCR 성공 여부를 확인하기 위해 1 % agarose gel에서 전기영동을 실시하였다. 또한, 타겟 영역이 정상적으로 증폭된 것인지 확인하기 위해, 전기영동으로 증폭이 확인된 PCR 산물을 대상으로 염기서열 분석 및 종 동정을 실시하였다. 염기서열 분석은 Macrogen사의 Sanger sequencing 서비스(ABI PRISM 3730XL Analyzer 기기 사용)를 통해 이루어졌다. 분석된 염기서열은 Geneious (v10.2.5)를 사용하여 Quality filtering 후 consensus 염기서열을 완성하였으며, 종 동정을 위해 NCBI GeneBank nr database를 대상으로 BLAST를 실시하였다.
Table 1.
Overview of primers used for amplification of DNA extracted from Pinus densiflora wood.
| Primer |
Primer sequence (5’ → 3’) |
Target region |
Size(bp) |
Annealing Temperature (°C) |
Reference |
|
trnM-trnV
|
F: GCTAAAGGCATCCCAATGAG |
Transfer RNA gene cluster (trnM-CAU and trnV-UAC) |
285 |
59 |
Lee et al., 2017
|
| R: TTCTCCAGGGTTGGAAATG |
|
rpoC1
|
F: AACGAGGTGCTCTACCTTGC |
RNA polymerase beta’ subunit |
298 |
54 |
Lee et al., 2018
|
| R: GACTCTCGCCGTATGAAAGC |
|
rbcL
|
F: ATGTCACCACAAACAGAAACTAAAGCAAGT |
Ribulose bisphosphate carboxylase large subunit |
1,381 |
62 |
Petit et al., 1998
|
| R: CTTCACAAGCAGCTAGTTCAGGACTCC |
Download Excel Table
4. 통계 분석
목재 조직의 생성 후 경과 시간, 즉 나이테 위치를 독립변수로, 측정한 DNA 농도(ng/μl)와 순도(A260/A280)를 종속변수로 설정하여 단순 선형 회귀분석을 실시하였다. 그리고 PCR 증폭 성공 여부를 종속변수로, 목재의 나이테 위치와, 추출된 DNA의 농도(ng/μl) 및 순도(A260/A280)를 독립변수로 하여, 로지스틱 회귀분석을 실시하였다. 통계 분석은 R software(V 3.3.2)의 ‘lm’과 ‘glm’ 함수를 사용하였다.
결과 및 고찰
총 24개 샘플(n=24)의 농도(ng/μl)와 순도(A260/A280)의 측정값을 확인한 결과(Table 2), 전체 샘플 농도(ng/μl)의 평균은 2.41(±1.84), 순도(A260/A280)의 평균은 1.16(±0.21)으로, 일반적으로 사용되는 잎의 DNA 농도 및 순도에 비해 상대적으로 낮았다(Fatima et al., 2018). 목재의 경우 DNA 추출 효율을 저해시키는 화학물질을 포함하고 있어 농도(ng/μl)와 순도(A260/A280) 모두 저하되었을 것으로 추정된다(Rachmayanti et al., 2009; Abdel-Latif and Osman, 2017).
Table 2.
Average of DNA concentration(ng/μl), purity(A260/A280) and PCR success rate by group of samples.
| Annual ring group |
Number of samples |
DNA conc.(ng/μl) |
DNA Purity (A260/A280) |
PCR success rate(%) |
|
trnM-trnV
|
rpoC1
|
rbcL
|
| 1~5 |
3 |
2.48 (±0.97) |
1.21 (±0.24) |
100 |
100 |
100 |
| 6~10 |
3 |
1.97 (±0.61) |
1.28 (±0.01) |
100 |
100 |
100 |
| 11~15 |
3 |
4.22 (±0.77) |
1.26 (±0.04) |
100 |
100 |
100 |
| 16~20 |
3 |
2.37 (±0.06) |
1.44 (±0.05) |
100 |
100 |
100 |
| 21~30 |
3 |
0.97 (±0.16) |
1.05 (±0.08) |
100 |
100 |
100 |
| 30~35 |
3 |
1.67 (±0.91) |
1.02 (±0.27) |
100 |
100 |
33.33 |
| 36~40 |
3 |
1.07 (±0.50) |
1.16 (±0.22) |
100 |
100 |
0 |
| 41~45 |
3 |
0.78 (±0.05) |
1.04 (±0.05) |
100 |
100 |
0 |
Download Excel Table
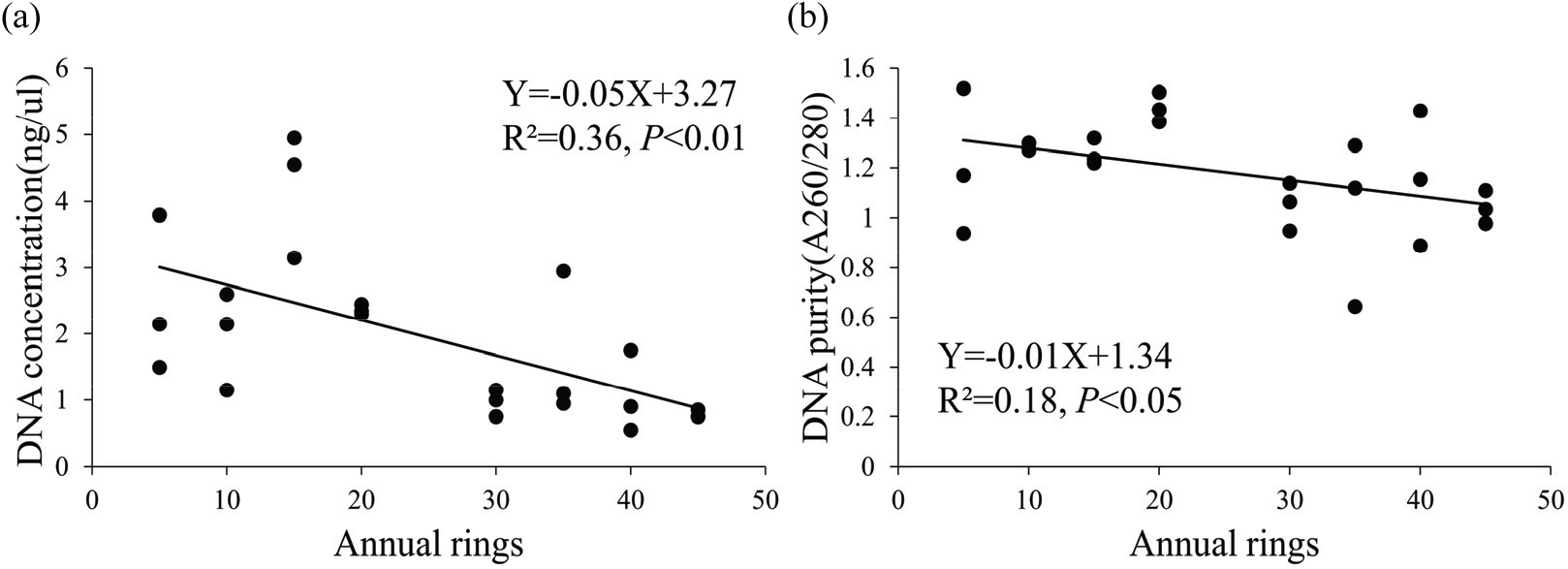
소나무 목재의 나이테 생성 시기에 따른 추출 DNA 농도(ng/μl)와 순도(A260/A280)에 대한 회귀분석 결과, DNA 농도는 나이테가 형성층으로부터 멀어질수록 유의하게 감소하였다[β=−0.05, P<0.01; Figure 2(a)]. DNA 순도 또한 형성층으로부터 멀어질수록 유의하게 감소하였다[β=−0.01, P<0.05; Figure 2(b)].
Figure 2.
The decrease in (a) DNA concentration(ng/μl) and (b) purity(A260/A280) by annual rings on wood disk of Pinus densiflora.
Download Original Figure
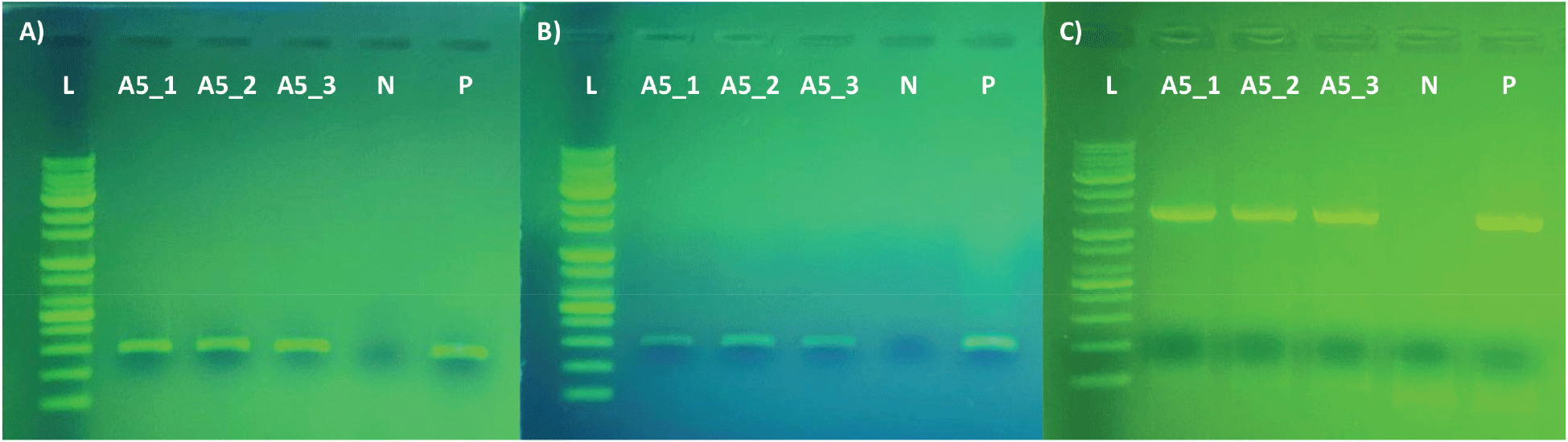
PCR 증폭 산물에 대한 전기영동 및 염기서열 분석을 통해 증폭 성공 여부를 확인하였다(Figure 3, Table 3). 확인 결과 trnM-trnV, rpoC1 partial 영역의 경우 총 24개의 샘플에서 모든 조건에서 증폭 성공률이 100 %로, 독립변수에 따른 변화를 볼 수 없었다(Table 2). rbcL partial 영역의 경우 24개 중 16개 시료에서 PCR을 성공하여 전체 증폭 성공률은 66.67 %였다(Table 2). 나이테에 따른 rbcL partial 영역 증폭 성공률은 30년 이하에서 15개 시료 모두 증폭에 성공하였고(100 %), 35년에는 3개 중 1개만(33 %) 증폭됐으며, 40년 이상에서는 6개 시료 모두 증폭에 실패하여(0 %), 오래된 조직에서 증폭 성공률이 낮음을 확인할 수 있었다(Table 2). 이 결과는 rbcL partial 영역의 증폭 산물 길이가 다른 영역(trnM-trnV, rpoC1 partial 영역)에 비해 길기 때문인 것으로 판단된다. 길이가 긴 영역의 경우 시간이 경과함에 따라 변형이 일어날 가능성이 높아 PCR 성공률이 감소하는 것으로 알려져 있다(Deguilloux et al., 2002; Lee et al., 2021). 목재 DNA와 같이 변형이 예상되는 DNA를 대상으로, 다양한 길이의 영역 또는 동일 영역 내 길이를 달리한 nested PCR 등의 연구를 통해 최적 증폭 영역 길이에 대한 구명 또한 필요할 것으로 판단된다.
Figure 3.
Example of agarose gel electrophoresis of the PCR products targeting A) trnM-trnV, B) rpoC1 partial region and C) rbcL partial region for DNA extracted from 1~5 annual ring group of Pinus densiflora wood. Lane L: BioFACT 1Kb Plus DNA ladder; A5_1~3: PCR products for DNA from 1~5 annual ring group; N: negative control; P: positive control (Leaf DNA of Pinus densiflora).
Download Original Figure
Table 3.
BLAST results identifying trnM-trnV, rpoC1 and rbcL region for DNA extracted from Pinus densiflora wood.
| Target region |
Accession no. |
Organism |
BLAST E-value |
Identity (%) |
|
trnM-trnV
|
MF990371 |
Pinus densiflora |
1.57e-140 |
100 |
|
rpoC1
|
MF990371 |
Pinus densiflora |
5.67e-145 |
100 |
|
rbcL
|
MF990371 |
Pinus densiflora |
0 |
100 |
Download Excel Table
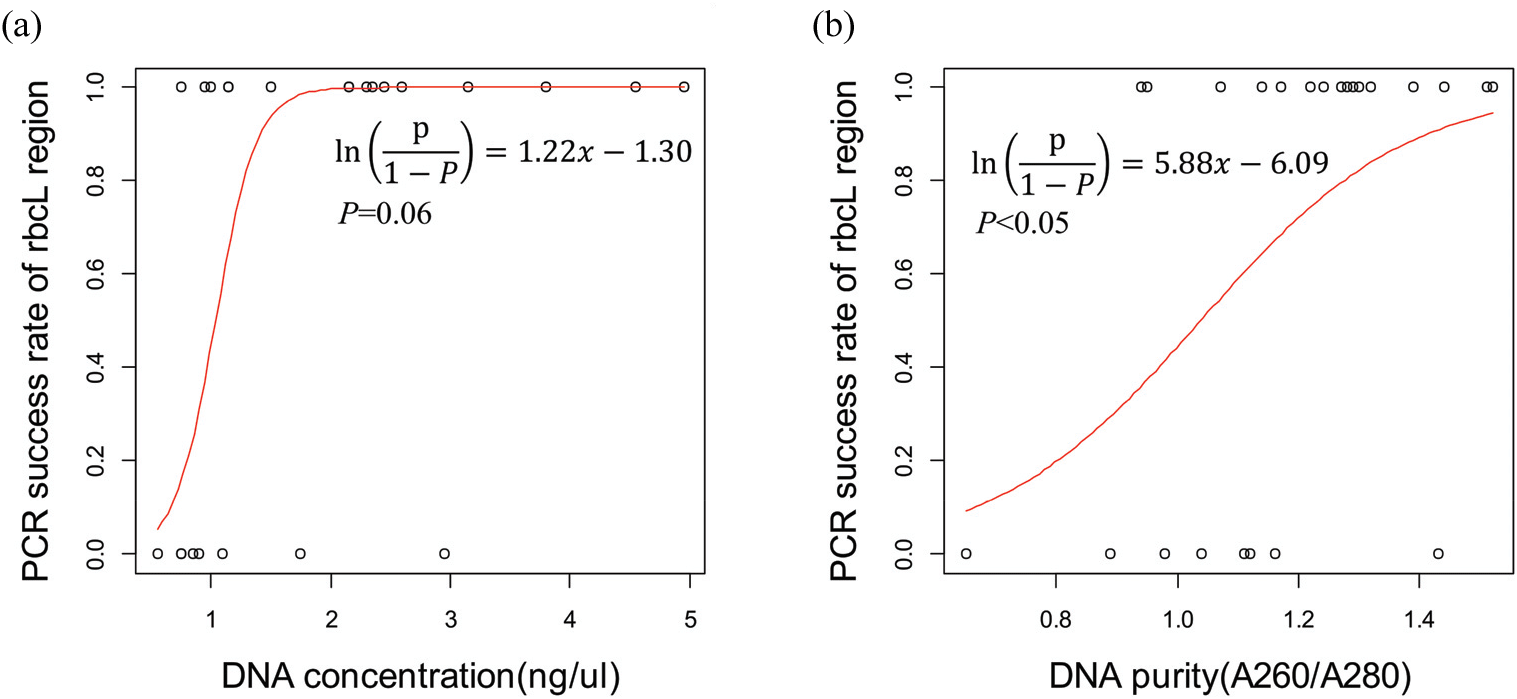
농도(ng/μℓ)에 따른 rbcL partial 영역 PCR 증폭 성공률에 대한 로지스틱 회귀계수는 유의한 증감을 나타내지 않았다[β=1.22, P=0.06; Figure 4(a)]. 그러나, 전체 DNA 농도 의 평균인 2 ng/μl 미만에서 PCR 성공률이 46.2 %(6/13), 2 ng/μl 이상에서는 90.9 %(10/11)의 성공률을 나타내는 것을 확인하였다. 한편, DNA의 순도(A260/A280)는 rbcL partial 영역 PCR 증폭 성공률에 유의한 영향을 주었다[β=5.88, P<0.05; Figure 4(b)]. 실험 결과에 따르면, DNA 순도(A260/A280)는 최소값 0.65에서 최대값 1.52의 범위였으며, 1.04에서 rbcL partial 영역 증폭 성공률과 실패율이 같아졌다. 이는 rbcL partial 영역의 PCR 성공률을 50 % 이상 기대하기 위해서는 DNA 순도(A260/A280)가 1.04 이상이어야 함을 의미하며, DNA 순도 1.27에서 PCR 성공률 80 %를 달성할 수 있을 것으로 예측된다. 나이테에 따른 DNA 순도 변화 회귀식에서 DNA 순도 1.04는 나이테 30.4년 지점이며, 순도 1.27은 6.9년에 해당한다[Figure 2(b)]. 30년이 지나지 않은 목재 조직에서는 모든 시료에서 rbcL partial 영역의 PCR에 성공했지만 이보다 오래된 목재 조직에서는 증폭 성공률이 감소한 것도 이 결과와 관련된 것으로 판단된다. 본 연구 결과에 의하면 DNA 순도에 대한 나이테 회귀식을 기준으로 80 % 이상의 높은 PCR 성공률을 달성하기 위해서는 나이테가 생성된 지 7년 이하의 조직에서 추출된 DNA를 활용하는 것이 적합할 것으로 판단된다.
Figure 4.
PCR amplification success rates. (a) DNA concentration(ng/μl), (b) DNA purity(A260/A280).
Download Original Figure
추출한 DNA의 농도는 시료 내 살아있는 세포의 양에 영향을 받으며, DNA를 이용하여 목재의 종 동정을 하기 위해서는 높은 농도와 우수한 순도의 DNA 시료가 필요하다. 형성층에 가까운 목질부에는 살아있는 유세포(parenchyma cell)가 풍부하게 존재하지만, 시간이 흐를수록 유세포는 사멸한다(Bamber, 1976; Deguilloux et al., 2002). 유세포 사멸과 함께 세포 내 DNA 또한 분해되기 때문에(Rachmayanti et al., 2009; Finkeldey et al., 2010), 나이테가 오래될수록, 즉 조직 생성 후 시간이 지날수록 추출된 DNA 농도가 감소하였을 것이다. DNA 순도 측정 단위로 사용된 A260/A280은 용액 내 잔류 단백질 대비 DNA 양과 관련하며, 단백질에 의한 DNA 오염을 확인할 수 있는 지표 중 하나로 활용될 수 있다(de Souza Borges et al., 2017; Gallagher, 2017). 목재 조직이 오래될수록 단백질 대비 DNA 양이 감소하여, 이 조직에서 추출된 DNA의 A260/A280 값도 감소하였을 것으로 추정된다. DNA 용액에 잔류하는 단백질들은 DNA 구조를 변형시키거나, polymerase의 작용을 방해하는 등 PCR 억제자(inhibitor)로 역할을 하기 때문이다(Schrader et al., 2012).
본 연구 결과는 오래되지 않은 신선한 목재 조직으로부터 DNA를 추출하여 사용하는 것이 증폭 실험을 위해 효율적이라는 것을 나타낸다. 목재 조직의 신선도와 DNA의 수율 및 증폭 효율과의 관계를 다루는 연구는 지금까지 나이테가 아닌 목재 부위에 따른 신선도를 판단하였다. 예를 들어, 아까시나무(Robinia pseudoacacia), 넓은잎삼나무(Cunninghamia lanceolata), 티크(Tectona grandis) 등의 목재를 대상으로 한 연구에서, 변재의 DNA 추출량과 PCR 성공률이 심재에 비해 높다는 것을 확인하였다(Filippis and Magel, 1998; Rachmayanti et al., 2009; Jiao et al., 2012; Fatima et al., 2018). 그러나, 개체의 생육 상태에 따라 변재와 심재의 면적이 다르며(Morling and Valinger, 1999; Bieker and Rust, 2010), 육안으로 그 위치를 정확히 구분하는 것이 어려울 수도 있다(Saito et al., 2008). 따라서, 명확히 확인 가능한 나이테를 이용하여 조직의 나이를 산정하고 DNA 양 및 순도와 PCR 성공률을 유추하는 것이 효율적일 수 있다. 한편, 본 연구에서는 소나무 한 종만을 대상으로 하였기 때문에, 목재 조직의 나이에 따른 DNA 농도와 순도, 그리고 PCR 성공률의 변화 양상을 명확히 규명하기 위해서 소나무 외의 다른 수종으로 대상을 확대할 필요가 있을 것으로 판단된다.
감사의 글
본 연구는 국립산림과학원의 “산림생명자원 유전정보 구축 및 바이오지문 분석기술 개발 연구(과제 번호: FG0601-2019-02)”의 지원으로 수행되었습니다.
References
Abdel-Latif, A. and Osman, G. 2017. Comparison of three genomic DNA extraction methods to obtain high DNA quality from maize. Plant Methods 13: 1-9.

,

,


Bamber, R.K. 1976. Heartwood, its function and formation. Wood Science and Technology 10(1): 1-8.


Bieker, D., and Rust, S. 2010. Non-destructive estimation of sapwood and heartwood width in Scots pine (
Pinus sylvestris L.). Silva Fennica 44(2): 267-273.


de Souza Borges, K.C.A., de Melo Dias, S., Galvão, E., Mendonça, R.C.C.L., Leandro, A.S., de Souza, S.R. and da Madeira, L.D.B. 2017. DNA extraction and anatomic characterization in dried heartwood from Fabaceae species. Wood Research 62(1): 13-26.

Deguilloux, M., Pemonge, M. and Petit, R. 2002. Novel perspectives in wood certification and forensics: dry wood as a source of DNA. Proceedings of the Royal Society of London. Series B: Biological Sciences 269: 1039-1046.

,

,


Filippis, L.D., and Magel, E. 1998. Differences in genomic DNA extracted from bark and from wood of different zones in Robinia trees using RAPD-PCR. Trees 12: 377-384.


Fatima, T., Srivastava, A., Hanur, V.S., and Rao, M.S. 2018. An effective wood DNA extraction protocol for three economic important timber species of India. American Journal of Plant Sciences 9(2): 139-149.


Finkeldey, R., Leinemann, L. and Gailing, O. 2010. Molecular genetic tools to infer the origin of forest plants and wood. Applied Microbiology and Biotechnology 85: 1251-1258.

,

,


Gallagher, S.R. 2017. Quantitation of DNA and RNA with absorption and fluorescence spectroscopy. Current protocols in immunology 116(1): A-3L.

,


Hebert, P.D. and Gregory, T.R. 2005. The promise of DNA barcoding for taxonomy. Systematic biology 54(5): 852-859.

,


Jiao, L., Yin, Y., Xiao, F., Sun, Q., Song, K. and Jiang, X. 2012. Comparative analysis of two DNA extraction protocols from fresh and dried wood of
Cunninghamia lanceolata (Taxodiaceae). Iawa Journal 33(4): 441-456.


Jiao, L., Liu, X., Jiang, X. and Yin, Y. 2015. Extraction and amplification of DNA from aged and archaeological
Populus euphratica wood for species identification. Holzforschung 69(8): 925-931.


Lee B., Kim, S., Lee, J., Lee, H. and Eo, SH. 2021. Polyvinylpyrrolidone (PVP) and proteinase-K improve the efficiency of DNA extraction from Japanese larch wood and PCR success rate. Forensic science international 328: 111005.

,


Lee, S., Chang, C., Kim, K., Song, S. and Bark, J. 2014. Impact analysis of the import regulation on illegally logged wood and wood products. Journal of Rural Development. 37(2): 39-58.

Lee, J.W., Hong, K.N., Hong, Y.P., Lee, S.W., Ahn, J.Y. and Baek, S.H. National Institute of Forest Science. 2017 Mar 16. Method of distinguishing between the red pine and the scot pine by using PCR-RFLP marker. Republic of Korea. 1017187070000.

Lee, J.W., Hong, K.N., Hong, Y.P., AN, J.Y., Kim, Y.M., Baek, S.H. and Park, Y.J. National Institute of Forest Science. 2018 Fev 07. Method of distinguishing between the red pine and the scot pine using molecular marker. Republic of Korea. 1018287740000.

Lowe, A.J. and Cross, H.B. 2011. The Application of DNA methods to Timber Tracking and Origin Verificat ion. IAWA Journal 32(2): 251-262.


Mörling, T. and Valinger, E. 1999. Effects of fertilization and thinning on heartwood area, sapwood area and growth in Scots pine. Scandinavian Journal of Forest Research 14(5): 462-469.


Ohyama, M., Baba, K. and Itoh, T. 2001. Wood identification of Japanese
Cyclobalanopsis species (Fagaceae) based on DNA polymorphism of the intergenic spacer between
trnT and
trnL 5′ exon. Journal of Wood Science 47: 81-86.


Petit, R.J., Demesure, B. and Dumolin, S. 1998. cpDNA and mtDNA primers in plants. Molecular Tools for Screening Biodiversity: Plants and Animals. 256-261.


Rachmayanti, Y., Leinemann, L., Gailing, O. and Finkeldey, R. 2009. DNA from processed and unprocessed wood: factors influencing the isolation success. Forensic Science International: Genetics 3(3): 185-192.

,


Saito, K., Mitsutani, T., Imai, T., Matsushita, Y., and Fukushima, K. 2008. Discriminating the indistinguishable sapwood from heartwood in discolored ancient wood by direct molecular mapping of specific extractives using time-of-flight secondary ion mass spectrometry. Analytical Chemistry 80(5): 1552-1557.

,


Schrader, C., Schielke, A., Ellerbroek, L. and Johne, R. 2012. PCR inhibitors-occurrence, properties and removal. Journal of applied microbiology 113(5): 1014-1026.

,


Tang, X., Zhao, G. and Ping, L. 2011. Wood identification with PCR targeting noncoding chloroplast DNA. Plant Molecular Biology 77: 609-617.

,