서 론
탄소중립은 우리나라 뿐만 아니라 전세계에서 주목하고 있는 목표 중 하나이다. 우리나라도 2020년 10월 탄소중립선언을 시작으로 ‘2030 국가온실가스 감축목표(NDC) 상향안(Related ministries jointly, 2021)을 제안하고 다양한 분야에서 온실가스 감축 및 신규 탄소흡수원 발굴 및 확충에 관한 목표를 제시하고 있다. 이와 관련하여 국내 생태계별 탄소흡수능력을 파악하고 그 현황과 탄소흡수원 확충을 위한 연구의 필요성이 높아지고 있다. 탄소흡수에 관한 국제적 노력으로 기후변화에 관한 정부간협의체(IPCC)는 해안생태계 탄소저감능력을 인정하여 2019년 해양 및 빙권 특별보고서에서 맹그로브숲 등을 포함하는 블루카본(Blue Carbon)을 온실가스 감축 수단으로 공식 인정하였다(Intergovernmental Panel on Climate Change, 2021; Ministry of the Environment Japan, 2023). 블루카본은 대기 중 이산화탄소가 광합성작용을 통해 맹그로브, 염습지 및 해초류와 같은 연안 생태계나 해조류, 미세조류와 같은 해양생태계에 의해 바이오매스로 흡수된 뒤 퇴적되어 장기간 저장되는 탄소를 의미한다(Bertram et al., 2021). 주요 블루카본 구성요소인 맹그로브숲은 온대림에 비해 3-5배 높은 탄소흡수 능력을 가지고 있어 우수한 탄소흡수원으로 주목받고 있다(Donato et al., 2011).
기후변화는 기온이나 강수 패턴 변화와 가뭄, 홍수 같은 극단적인 기상 이벤트의 발생 빈도를 증가시켜 생물종 서식지 환경 변화에 직간접적으로 영향을 준다(Iverson et al., 2014). 이로 인해 전지구적으로 생물종 분포 범위와 식생분포대가 변화하고 있으며, 특히 온대 및 열대 동·식물의 분포 면적이 점차 확대되고 있다(Walther et al., 2002; Hegland et al., 2009; Habary et al., 2017). 국내에서도 기후변화로 인한 생물종 분포 범위 변화가 지속적으로 보고되고 있다(Shin et al., 2021). 종분포모델의 기후변화 시나리오 적용시 동아시아에 주로 분포하는 생물종들이 제주도 및 한반도 일부로 확장되며, 진정 맹그로브 중 일부 수종은 제주도 및 남해안 도서지역에서의 생육 가능성이 있는 것으로 확인되었다(Lee et al., 2023).
맹그로브는 연평균 기온을 기준으로 19°C 이하일 경우 생장이 저하되는 것으로 보고되었으며, 영하의 온도에서 생장할 수 없다고 알려져 있다(Alongi, 2002). 이와 같은 이유 때문에 제한된 기후대에서만 서식하며, 이외의 지역에서는 온도 및 습도 영향으로 생육이 감소하여 한정적인 위도의 범위 내에 분포하고있다(Alongi, 2022).
본 연구에서는 기후변화 시나리오 적용시 국내 유입 가능한 수종 중 베트남 북부, 인도, 스리랑카 등 남아시아와 동남아시아 맹그로브 숲에서 흔히 볼 수 있는 종인 Sonneratia caseolaris (L.) Engl. 대상으로 기초적인 서식가능 조건을 구명하기 위해 발아 실험을 진행하였다. 맹그로브 관련 연구는 주로 생리활성이나, 생태계서비스 등 맹그로브 수종에 대한 생태×사회적 연구가 주를 이루고 있으며(Simlai et al., 2014), 맹그로브 비태생종자에 대한 발아실험 연구는 거의 이루어지지 않고 있다. 베트남에서는 퇴적 토양이 있는 곳에서 씨앗을 심고, 일정 크기 이상 자란 묘목에 한해 이식을 진행하는 등의 전통적인 증식 방법을 주로 사용하고 있다(Asian Forest Cooperation Organization, 2020; Trench 2021; Abraham et al., 2023). 그러나 수종별 발아 조건 등 양묘×증식 방법 또는 생장특성에 따라 서식 가능한 기초적인 조건과 발아 제한 조건에 대한 연구는 많지 않다. 기존 연구 중 스리랑카에서 같은 종으로 발아에 미치는 염분의 영향을 조사한 사례가 있으나(Wijayasinghe et al., 2019) 이 연구는 염분 농도가 상대적으로 낮게 설정되고 온도 범위가 제한적인 조건에서 수행되었기 때문에, 보다 광범위한 염도 및 온도 조건에서의 실험을 수행함으로써, 맹그로브 수종 종자 발아에 대한 더욱 포괄적인 이해가 필요하다.
본 연구의 목적은 맹그로브 수종인 S. caseolaris을 대상으로 발아 온도 및 염분 농도에 따른 발아 특성을 알아보고자 한다. 이를 통해 S. caseolaris종자의 발아에 온도와 염분 스트레스가 발아 과정에 미치는 영향을 평가하고자 한다. 이를 위해 S. caseolaris생육 적합 온도와 극한 온도, S. caseolaris자생지 염분 농도와 극한 농도를 설정하여 발아율을 측정하였다. 맹그로브 수종인 S. caseolaris종자가 발아하는 조건에서 온도와 염분이 얼마나 민감하게 영향을 주는지를 전반적으로 검토하고 이 결과를 토대로 맹그로브 생태계의 변화에 따른 이 수종의 적응력과 생존 전략을 파악하는 데 중요한 정보를 제공할 수 있는 기반을 마련하고자 한다.
재료 및 방법
S. caseolaris는 보통 높이 15~20m에 달하는 상록수이다. S. caseolaris는 보통 4~ 5월에 꽃이 핀다. 열매는 10~ 11월에 익으며, 성숙하면 짙은 녹색의 지름 2~4.5 cm에 달한다(Van Thuoc et al., 2018). 열매의 모양 때문에 S. caseolaris는 종종 맹그로브 사과나무라고도 불리며 열매 한 개당 100~150개의 종자가 들어 있다. 종자는 장과(漿果)로 단단하고 둥글고 납작하며 밑부분에 컵 모양의 꽃받침이 있다. 또한 이 종자는 불규칙적인 각이 져 있고, 물에 뜨는 특성을 가진다(Figure 1). 맹그로브의 태생종자(Viviparous Seed)는 수정된 종자가 모체에서 떨어지기 전에 발아하여 묘목 형태로 자라난 후, 충분히 성장하면 모체에서 떨어져 나가 서식지에 정착하는 것을 말하며, Rhizophora 속이 대표적인 것으로 알려져 있다. 맹그로브 비태생종자는 다른 말로 일반 종자 (Non-viviparous Seed)로 불리며, 수정된 종자가 모체에서 떨어져 나가 일반적인 씨앗 형태로 발아하는 것을 말한다. 맹그로브에서는 Avicennia 속이 대표적인 것으로 알려져 있다. 대상 종인 S. caseolaris의 종자는 비태생종자이다(Aluri, 2022).

실험에 사용된 종자는 베트남 남딘성(Nam Dinh, Vietnam) 맹그로브 국립공원(Xuan Thuy National Park)에서 2023년 9월에 수집하였으며, 10월 초 국내 식물종자검역소 검역 완료하였다. 종자를 정선하기 위해 물로 과육을 씻어 제거하였다.
S. caseolaris종자 발아의 기초적인 조건을 구명하고자 맹그로브 수종 생육 적합 온도 및 염도와 극한 온도 및 염도를 포함한 조건별 실험을 수행하였다(Table 1). 밀도나 수분에 관한 조건은 처리구 모두 동일하였다. 온도는 자생지(Nam Dinh, Vietnam) 평균기온 24°C(T-24)를 기준으로 19°C(T-19), 24°C(T-24), 30°C(T-30), 38°C(T-38)로 처리하였다. 염도는 베트남 북부의 S. caseolaris자생지 염도(10~47‰, Table 1)를 기준으로 0‰(S-0), 10‰(S-10), 20‰(S-20), 25‰(S-25), 30‰(S-30), 35‰(S-35), 40‰(S-40)로 처리하였다. 발아실험은 9 cm직경의 Petri Dish에 여과지(Whatman No.1, Ge Healthcare, Buckinghamshire) 1장을 깔고 종자를 무작위로 선정하여 각 조건별로 10립씩 치상하였다. 온도 처리구는 증류수 10mL씩 분주하였고, 염분 처리구는 각 농도의 용액을 10mL씩 분주하였다. 모든 처리구는 4개의 챔버(Multi Room Incubator VS-3125Qi, VISION SCIENTIFIC CO., LTD, Korea)를 이용하여 온도별로 분배하였고, 광주기는 12시간/12시간의 명암 비율로 진행하였다(Kim et al., 2022). 염분 처리구는 생육 적합지 평균온도인 30°C에서 실험을 수행하였다.
| Experiment treatment | ||||||||
|---|---|---|---|---|---|---|---|---|
| Temperature treatment | T-19 | 19°C | T-24 | 24°C | T-30 | 30°C | T-38 | 38°C |
| Salinity treatment | S-0 | 0 | S-10 | 10 | S-20 | 20 | ||
| S-25 | 25 | S-30 | 30 | S-35 | 35 | S-40 | 40 | |
실험은 2023년 10월 11일부터 2023년 10월 25일까지 진행하였으며, 파종 후 유근이 1.00 mm 이상 출현하였을 때부터 발아한 것으로 간주하였다. 발아특성은 3일 간격으로 모니터링하였으며, 발아 후 초기생장을 측정하기 위하여 치상 후 15일 째에 유근의 길이를 측정하였다. 발아 특성을 분석하기 위해 발아율(Germination Rate, GR), 평균발아일수(Mean Germination Time, MGT), 발아균일지수(Germination Perfomance Index, GPI)를 산출하였다(Yoo et al., 2012; Jin et al., 2022). 발아율(GR)은 특정 기간 동안 발아한 종자의 비율을 나타내며, 발아한 종자의 수를 전체 심은 종자의 수로 나누어 백분율로 표현한다(식 1). 발아율은 종자 생존력과 발아 능력을 평가하는 데 사용되며, 높은 발아율은 대체로 종자의 품질이 우수하고 적절한 조건 일 경우 대부분의 종자가 성공적으로 발아 할 수 있음을 의미한다. 평균발아일수(MGT)는 종자가 발아하는 데 걸리는 평균 시간으로 각 종자의 발아일까지의 일수를 모두 합한 후 발아한 종자의 수로 나눈다(식 2). 평균발아일수(MGT)는 발아 과정의 속도를 평가하는 데 사용되며, 짧은 평균발아일수(MGT)는 씨앗이 빠르게 발아한다고 볼 수 있다. 발아균일지수(GPI)는 종자의 발아가 얼마나 일관되게 진행되는지를 나타내는 지표로, 발아율(GR)과 평균발아일수(MGT)를 사용하여 계산한다(식 3). 높은 발아균일지수(GPI)는 발아 과정이 균일하고 동시에 이루어짐을 의미한다.
N : 총 발아수, S : 총 공시 종자 수, ti: 치상 후 조사일수, ni: 조사 당일의 발아수
결과 및 고찰
본 연구에서는 최적 발아 조건 중 온도를 중점으로 처리구를 구성하였다. 생육적합지 평균 온도인 T-30처리구에서 발아율(GR)이 88.00 ± 10.95%로 가장 높았다(Table 2). T-24처리구에서는 80.00 ± 12.25%, T-38 처리구에서는 86.00 ± 8.94%, T-19처리구에서는 34.00 ± 26.08%의 발아율을 보였다. T-19 처리구에서는 T-24, T-30, T-38 처리구들에 비해 유의한 수준으로 낮은 발아율을 보였다. 맹그로브 수종의 특성으로 온도가 높을 수록 발아율이 높을 것으로 예상되었으나 저온 처리구인 T-19조건을 제외한 나머지 3개의 처리구에서는 발아율이 80% 이상으로 나타났으며 T-24, T-30, T-38 처리구간의 통계적 차이가 없었다. 일별 발아율이 50%에 도달하는 시점은 최고 기온(T-38) 조건에서 치상 1일 후부터 가장 빠르게 나타났다(Figure 2). 평균 발아일수(MGT)는 T-38 조건에서 1.50 ± 0.49일로 가장 빨랐으며, T-30 조건에서 2.66 ± 0.62일, T-24조건에서 5.10 ± 0.62일, T-19조건에서 6.77 ± 4.50일로 가장 느린 것으로 나타났다. 발아균일지수(GPI)는T-38 조건에서 60.38 ± 17.30으로 가장 높았고, T-30 조건에서 34.52 ± 7.57, T-24 조건에서 15.87 ± 1.77, T-19 조건에서는 3.43 ± 2.13으로 온도가 높을 수록 발아균일지수 값이 높은 것으로 나타났다. Castro 등(2004)과 Cassaro-Silva (2001)에 의하면 발아 속도는 온도에 의존적이며 온도 상승에 따라 물의 에너지가 증가하여 확산 압력이 높아지고, 동시에 대사 활동을 증가시켜 종자의 내부의 물의 흡수를 촉진한다고 보고했다. 이와 비슷하게 본 연구의 고온 처리구인 T-38에서는 고온 처리에 따라 종자 내부 물의 흡수 증가로 발아 속도를 향상시켜 가장 빠른 발아율과 평균발아일수를 보인 것으로 사료된다. 또한, 발아균일지수의 수치가 높을수록 종자가 발아하는데 유리한 것으로 보인다는 연구 결과에 따라(Sundstrom et al., 1987; Choi and Seo, 2009), S. caseolaris 종자의 온도 처리구에서 GPI값이 가장 높았던 T-38 조건에서 가장 유리한 것으로 보인다.
Note : Values with different letters in column indicate statistical differences treatments at the 5% levels by Tukey’s HSD test. a)GR: Germination rate, b)MGT: Mean Germination time, c)GPI: Germination performance index, d)Length of radicle: Mean length of radicle. *Mean Length of root as mean ± SD. of data obtained from five independent experiments. Values with the different letter (a-b) indicate significant difference among four treatments (P < 0.05)
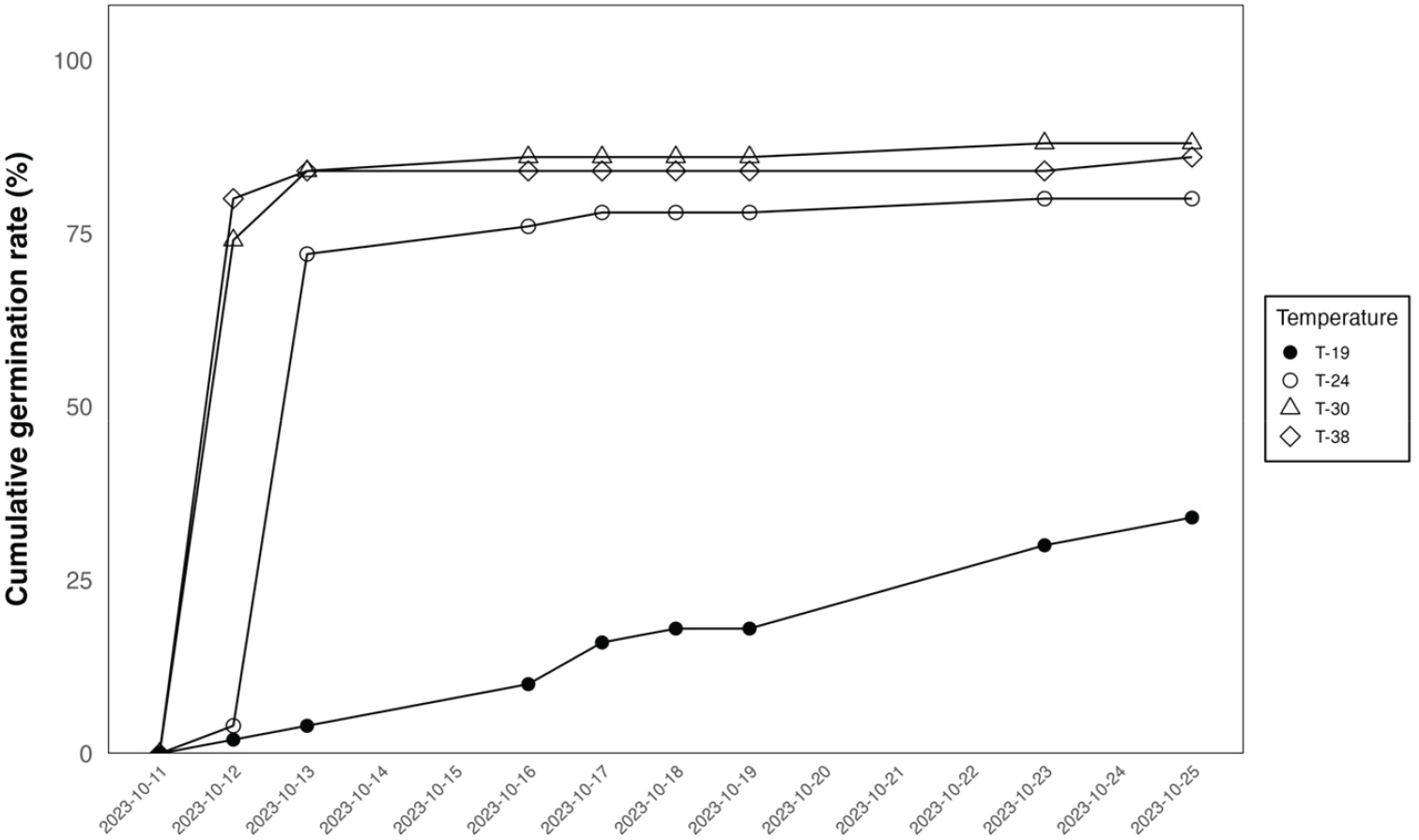
선행 연구에 따르면 온도는 식물의 발아, 성장과 발달에 중요한 역할을 하며, 식물의 종에 따라 최적 온도는 매우 상이하다. 또한 온도, 수분, 밀도 혹은 전처리 조건 사이의 상호작용으로 인한 발아 및 생장 반응 또한 매우 상이한 것으로 알려져 있다. Pinus bungeana 나 Brassica napus L. 같이 북반구에 널리 분포하는 식물들은 15°C와 20°C 사이에서 높은 발아율을 보인다(Brancalion et al., 2010; Haj Sghaier et al., 2022). 반면, 열대지역에 서식하는 수종 또한 최적 발아 온도는 종마다 다르지만, Diptychandra aurantiaca 등에 대하여 최적 발아 온도는 25-30°C로 관측되었다(Oliveira et al., 2013). D. aurantiaca경우, 20°C의 온도에서는 오히려 대사 반응 속도가 감소하는 현상이 발생하여 발아를 시작하는 필수 과정에 영향을 미칠 수 있다고 보았다. 특히 열대 및 아열대 지역에 서식하는 종에게 낮은 온도는 발아 과정에서 피해를 발생시킬 수 있으며, 발생하는 피해 정도는 종자의 초기 수분 함량, 온도 및 노출 시간에 따라 달라질 수 있다고 보고되었다(Carvalho and Nakagawa, 2000; Ferreira and Borghetti, 2004; Taiz and Zeiger, 2009). 본 실험의 T-19 처리구는 대사 반응 속도가 감소하는 20°C 보다 낮은 온도이며, 온도 처리구들 중 가장 낮은 발아율을 보였다. T-19 처리구에서 낮은 온도에 노출된 시간이 최종 발아율에 영향을 주었을 것으로 추측된다.
유근 생장 결과에서는T-30조건에서 25.24 ± 9.44 mm로 가장 높은 값을 보인 반면, 저온 처리구인 T-19조건에서 1.62 ± 1.11 mm로 가장 낮은 생장을 보였으며, T-30조건과 비슷한 발아율을 보인 극한 기온 처리구인 T-38조건에서는 4.78 ± 0.59 mm로 생장 값이 가장 낮았다(P < 0.05). 식물체의 유근 생장에서는 높은 온도가 호르몬 혹은 생장을 저해할 수 있고, 핵막 등에서 종자가 수분을 흡수하는 것을 방해할 수 있다(Gladish et al., 1993; Guo et al., 2018). 본 연구의 고온 처리구인 T-38에서 높은 온도가 유근의 초기 생장을 저해하는 영향을 끼쳤을 것으로 보인다. 저온 처리구인 T-19에서는 비록 낮은 발아율을 보이기는 했으나 측정 기간 동안 발아율이 계속 증가하는 것으로 보아, 저온에서의 생장 가능성을 무시 할 수 없을 것으로 판단된다. 맹그로브 수종 중Black mangrove로 알려진 Avicennia germinans (L.) L.의 경우는 영하의 온도가 되어도 일정 기간 생존할 수 있는 것으로 알려져 있어 맹그로브 수종의 저온 스트레스에 대한 적응 기작이 있을 것으로 보인다(Pickens et al., 2011). 전지구적인 기후변화가 진행되는 현재 상황에서A. germinans의 추위에 대한 생존 전략 가능성은 다른 맹그로브 수종에 대한 생육지의 확장 가능성도 고려할 필요성이 있음을 시사한다. 이는 휴면 혹은 고사가 진행되는 S. caseolaris의 발아 및 생육 최저 온도에 대한 연구가 추가적으로 필요한 것으로 보인다.
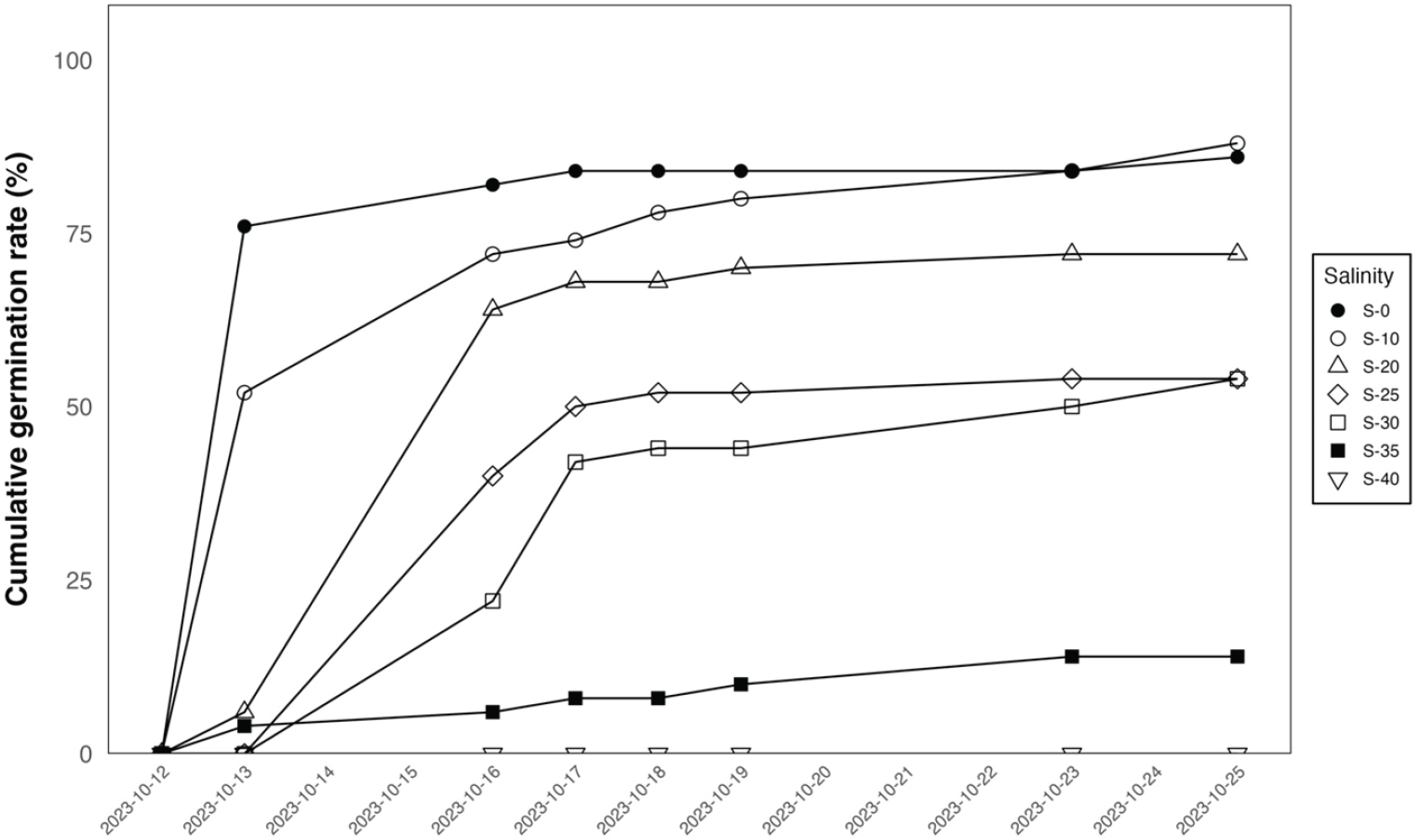
염도 처리에 따른 발아특성(Table 3)을 조사한 결과, 10‰ 이하의 낮은 염도에서의 발아율은 88.00 ± 8.37%로 다른 염도 처리구와 비교하여 가장 높은 것으로 나타났다(P < 0.05). 발아율은 각각 S-0 조건에서 86.00 ± 11.40%, S-20 조건에서 72.00 ± 4.47%, S-25, 30 조건에서 54.00 ± 5.48%, S-35 조건에서 14.00 ± 16.73%로 나타났다. 평균 해수의 염도보다 높은 처리구인 S-40 조건에서는 측정 기간 동안 전혀 발아가 이루어지지 않았다. 일별 발아율을 보면 종자 치상 2일 뒤부터 발아가 시작되었다(Figure 3). 평균 발아일수(MGT)는 S-0조건에서 2.59 ± 0.73일로 가장 빨랐으며(P < 0.05), S-10 처리구에서 4.16 ± 1.24일, S-20 처리구에서 5.10 ± 0.40일, S-25 처리구에서 5.53 ± 0.50일, S-30 처리구에서 6.73 ± 1.42일, S-35 처리구에서 3.80 ± 3.56, S-40 처리구에서는 측정 기간 동안 발아가 이루어지지 않아 평균 발아일수를 나타낼 수 없었다. GPI는 S-0 조건에서 35.10 ± 8.76으로 가장 높았고, S-10 조건에서 22.55 ± 6.08, S-20 조건에서 14.19 ± 1.07, S-25 조건에서 9.82 ± 0.82, S-30 조건에서 8.29 ± 1.59, S-40조건을 제외하면 S-35조건에서 1.36 ± 1.28로 가장 낮은 것으로 나타나(P < 0.05), S-0 조건에서 종자 발아가 균일하게 이루어졌음을 알 수 있다. 유근생장을 측정한 결과, S-10 조건에서 39.98 ± 8.13 mm (P < 0.05)로 가장 높은 값을 보였고, S-0 조건에서 37.66 ± 4.93 mm, S-20 조건에서 14.38 ± 2.00 mm, S-25 조건에서 6.50 ± 1.64 mm, S-30 조건에서 5.68 ± 2.23 mm,측정 기간 동안 발아가 되지 않았던 S-40조건을 제외하면, S-35조건에서 0.80 ± 0.97 mm (P < 0.05)로 가장 낮은 값을 보였다. 맹그로브는 해안에 사는 수종으로 알려져 있어 염도에 민감하지 않을 것으로 예상되었으나, 본 연구에서는 낮은 염도 처리구인 S-0,10 처리구에서 발아율이 가장 높았다. 높은 NaCl 농도에서 이온 독성 효과(Baskin and Baskin, 1998)는 높은 염도에서 종자 생존력이 감소하는 이유 중 하나이며, 염생 식물의 높은 NaCl 농도에서 발아와 생존력이 감소하는 연구가 보고되었다(Khan and Ungar, 1996). Khan and Ungar(1996)은 Haloylon recurvum 종자가 높은 염분 농도에서 견딜 수 있지만 증류수에서 가장 높은 발아율을 보였다고 보고하였으며, 이는 본 연구 결과에서도 비슷한 경향을 나타내었다. S. caseolaris의 발아 및 초기생장에 적합한 염도는 0~10‰의 낮은 염도로 보이며, 평균 해수 농도인 30‰ 이상에서는 발아율이 54%로 절반 가까이 감소하는 것을 보아 염분에 대한 이온 스트레스가 발생되어 발아율이 저하되었을 것으로 사료된다. 또한 발아의 최적화는 생존과 번식 성공률을 높이는 중요한 전략으로, 종자가 최적의 생존, 성장 환경을 인식하여 발아 시점을 조절, 유도하고 종자 발아 후 불확실한 환경에서의 생존 가능성을 높이는 전략은 종마다 매우 상이하며, 이에 필요한 필요 조건 역시 다양하다(Donohue et al., 2010; Haj Sghaier et al., 2022). 본 연구의 대상종인 S. caseolaris는 비태생종자이며, Aegiceras corniculatum (태생) 종자가 Acanthus ilicifolius (비태생) 종자보다 염분 내성이 더 높다고 보고했으며, 이러한 관찰의 이유는 태생 종의 경우 발아와 후속 발달이 모체에 붙어있는 동안에 이루어지기 때문일 수 있다고 보고하였다(Tomlinson, 1994; Ye et al., 2005). 따라서 최적화된 발아 특성을 규명하기 위하여 여러 가지 발아 전처리와 환경 조건에 대한 상호작용과 반응에 대해 구명해야 할 필요가 있다고 사료된다.
Note: Values with different letters in column indicate statistical differences treatments at the 5% levels by Tukey’s HSD test. a)GR: Germination rate, b)MGT: Mean Germination time, c)GPI: Germination performance index, d)Length of radicle: Mean length of radicle. *Mean Length of root as mean ± SD. of data obtained from five independent experiments. Values with the different letter (a-c) indicate significant difference among seven treatments (P < 0.05)
결 론
본 연구에서는 맹그로브 수종인 S. caseolaris 종자의 발아에 미치는 온도와 염분 농도의 영향을 조사하여 발아 조건을 파악하였다. 온도 30°C와 염도 10‰에서 발아율과 유근 생장이 가장 높은 것으로 나타났다. 특히, 30°C에서는 발아율 88%와 유근 생장 25.24 mm를 기록하였고, 염도 10‰에서는 발아율 88%와 유근 생장 39 mm를 보였다. 반면, 높은 온도(38°C)와 염도(40‰)에서는 발아율과 유근 생장이 크게 저하되었다. 이러한 결과는 S. caseolaris 종자가 특정 온도와 염도 조건에서 최적의 발아와 초기 생장을 보인다는 것을 시사한다.
본 연구는 S. caseolaris 종자의 발아와 초기 생장에 적합한 온도와 염도 범위를 제시함으로써, S. caseolaris의 효과적인 관리와 보전에 중요한 정보를 제공한다. 다만, 본 연구는 제한된 조건 하에 수행되었기 때문에, 다양한 환경 요인들을 고려한 추가 연구가 필요하다. 이를 통해 S. caseolaris 종자의 발아와 생장에 대한 보다 포괄적이고 실질적인 정보를 제공할 수 있을 것이다.






